
题目列表(包括答案和解析)
22.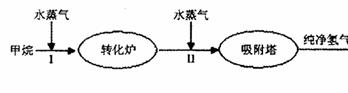 (9分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如
(9分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如
下图:
(1)此流程的第II步反应为:CO(g)+H2O(g)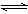 H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;反应的平衡常数随温度的变化如表一,
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=
;反应的平衡常数随温度的变化如表一,
|
温度/℃ |
400 |
500 |
830 |
1000 |
|
平衡常数K |
10 |
9 |
1 |
0.6 |
从上表可以推断:此反应是_______________ (填“吸”、“放”)热反应。
在830℃下,若开始时向恒容密闭容器中充入CO与HzO均为1 mo1,则达到平衡后
CO的转化率为_____。
(2)此流程的第II步反应CO(g)+H2O(g)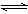 H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有
(填实验编号);
H2(g)+CO2(g),在830℃,以表二的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有
(填实验编号);
|
实验编号 |
N(CO) |
N(H2O) |
n(H2) |
N(CO2) |
|
A |
1 |
5 |
2 |
3 |
|
B |
2 |
2 |
1 |
1 |
|
C |
0.5 |
2 |
1 |
1 |
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是
① 体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④ 各组分的物质的量浓度不再改变 ⑤ 体系的温度不再发生变化 ⑥ v(CO2正)= v(H2O逆)
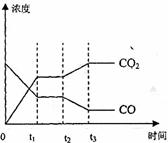 (4) 图表示该反应此流程的第II步反应在时刻
(4) 图表示该反应此流程的第II步反应在时刻
t 达到平衡、在时刻t
达到平衡、在时刻t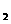 分别因改变某个条
分别因改变某个条
件而发生变化的情况:图中时刻t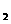 发生改
发生改
变的条件是_________。(写出两种)
(5)若400℃时,第Ⅱ步反应生成l mol氢气的热量数值
为 33.2(单位为kJ),第Ⅰ步反应的热化学方程式为:
CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3 kJ·mol-1。
则400℃时,甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
卤族元素的单质及其化合物的用途极其广泛,请回答23、24两题
21. (7分) 德国克莱斯公司成功研制了利用甲醇
(7分) 德国克莱斯公司成功研制了利用甲醇
车载制氢氧燃料电池工艺,其原理如右图所示,
请观察此图回答:
(1) 甲醇质子交换膜燃料电池中将甲醇蒸气转化
为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H= + 49.0 kJ·mol-1
②2CH3OH(g)+O2(g)=2CO2(g)+4H2(g);△H=-385.8kJ·mol-1
下列说法正确的是
A. 反应①中反应物的总能量高于生成物的总能量
B. 反应①中拆开CH3OH(g)和H2O(g)中的化学键所需能量大于形成CO2(g)和3H2(g) 中的化学键所释放的能量
C. CH3OH蒸气的燃烧热为大于192.9 kJ·mol-1
D.根据②推知反应:2CH3OH(l)+ O2(g)=2CO2(g)+4H2(g)的△H>-385.8kJ·mol-1
(2)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液
中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。若有2.2kg CO2
与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5 kJ的热量,试写出
 合成塔中发生反应的热化学方程式
。
合成塔中发生反应的热化学方程式
。
(3)可给笔记本电脑供电的甲醇燃料电池已经面世,其
结构示意图如右图。甲醇在催化剂作用下提供质子
(H+)和电子,电子经外电路、质子经内电路到达另
一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。b处通入的物质是 ,负极反应式为: 。
20.(15分)某实验小组同学对电化学原理进行了一系列探究活动。
 (1)右图为某实验小组依据氧化还原反应:(用离子方程式表示)
(1)右图为某实验小组依据氧化还原反应:(用离子方程式表示)
设计的原电
池装置,一段时间后,两电极质量相差
12g,导线中通过 mol电子。
(2)其它条件不变,若将CuCl2溶液换为
NH4Cl溶液,石墨电极反应式为 ,
这是由于NH4Cl溶液显 性,(填酸性、碱性或中性)用离子方程式表示溶液显此性的原因 ,用吸管吸出铁片附近溶液少许至于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,
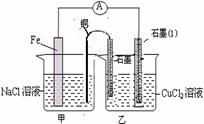 一段时间后,在甲装置铜丝附近滴加
一段时间后,在甲装置铜丝附近滴加
酚酞试液,现象是 ,电极
反应为 ;乙装置中石墨(1)为 极(填正、负、阴、阳),
乙装置中与铜线相连石墨电极上发生
的反应式为 ,产物常用
检验,反应的离子方程式为 。
近来,制备和利用氢气这一清洁能源已有多项成果,请回答21、22两题
19.(5分)现有一瓶浓度为0.2 mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种。
为了确定该酸溶液的组成进行实验:取25.00 mL0.1 mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50 mL。请回答:
(1)该酸不可能是 ;
 (2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为 ,用离子方程式说明溶液呈碱性的原因
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为 ,用离子方程式说明溶液呈碱性的原因
;
(3)实验中滴定曲线如右图,
在B点,a 12.5(填大于、小于或等于)
在C点各离子浓度由大到小排序
。
18. 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB= aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:

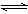 X(g)+Y(g) 2Z(g)+W(g) △H>0;达到平衡时,VA=1.2aL,则下列说法错误的是( )
X(g)+Y(g) 2Z(g)+W(g) △H>0;达到平衡时,VA=1.2aL,则下列说法错误的是( )
① 反应开始时,B容器中化学反应速率快
② A容器中X的转化率为40%,且比B容器中X的转化率大
③ 打开K达新平衡后,升高B容器温度,A容器体积会增大
④打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
A. ①②③④ B. ①②③ C. ② ④ D. 只有④
II卷(58分)
17. 控制适合的条件,将反应Fe2++Ag+
控制适合的条件,将反应Fe2++Ag+  Ag
+ Fe3+设计成如下图所示的原电池。下列判断错误的是
Ag
+ Fe3+设计成如下图所示的原电池。下列判断错误的是
A.反应开始时,电子从甲中石墨经导线流向乙中石墨
B.电流计指针为零时,上述反应的正反应速率等于
逆反应速率
C.电流计读数为零后,在甲中加入FeCl3固体,
乙中石墨电极反应为Ag - e- == Ag+
D.电流计读数为零后,在乙中加入硫化钠固体,电流计指针读数仍为零。
16.
 X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是
X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是
图I 图II 图III
 A.该反应热化学方程式为X(g)
+3Y(g)
2Z(g) △H= -(E2―E1)
A.该反应热化学方程式为X(g)
+3Y(g)
2Z(g) △H= -(E2―E1)
B.若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线
C.若升高温度,该反应的平衡常数减小,Y的转化率降低
D.图II中曲线b是加入催化剂时的能量变化曲线,曲线a一定是没有加入催化剂时的能量变化曲线
15.常温下,①PH=10氨水 ②PH=10氢氧化钠溶液 ③PH=4 HA溶液 ④PH=4 HB溶液,对下列四种溶液的叙述正确的是
A.②、④两溶液相比,两者的kw相同,水的电离程度不相同
B.若酸性HA比HB的强,则等物质的量浓度的NaA、NaB溶液PH:NaA>NaB
C.一定体积①、10mL③ 两溶液混合,PH=7,V总≥20mL
D.等体积的②,分别用③、④中和,消耗酸溶液的体积V③ > V④,则说明HA的酸性比HB的酸性强
14.某温度下,在容积固定不变的密闭容器中发生下列可逆反应:
2X(g) + Y(g)  2Z(g) △H =-Q kJ/mol平衡时,X、Y、Z的物质的量分别为1 mol、
2Z(g) △H =-Q kJ/mol平衡时,X、Y、Z的物质的量分别为1 mol、
1 mol、2 mol,放出热量Q kJ,保持温度不变,再向容器中分别充入1 mol、1 mol、2 mol的X、Y、Z,则下列叙述中正确的是
A.原平衡时,X的转化率为50%
B.达到新平衡时,X的转化率不变
C.达到新平衡时,容器内气体的平均相对分子质量增大
D.达到新平衡时,平衡常数K增大
13.工业制硝酸的其中一步反应为氨的氧化,反应方程式为:
4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g) △H< 0。有关该反应的说法正确的是
4NO(g)+ 6H2O(g) △H< 0。有关该反应的说法正确的是
A.反应达到平衡后,3ν正(NH3)=2ν逆(H2O)
B.反应处于平衡状态时,c(NH3)·c(O2)=c(NO)·c(H2O)
C.其它条件不变,温度越高,氨的转化率越高
D.增大压强是加快反应速率并提高NO产率的有效措施
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com