
题目列表(包括答案和解析)
17.(13分)
(1)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。w ww.k s5u. co m
(2)正确的顺序为:⑥→③→ 。
(3)适宜的加热方式是 。
(4)化学方程式为 。
(5)①名称为 。w ww.k s5u. co m
②主要原因是 。
③质量分数为 。
16. (11分)
(1)目的是 。
(2) 。
(3)最大区间为 。
(4)合适的反应物是 (选填序号)。
(5) 操作依次为 、 、过滤、洗涤、干燥。
(6) 质量分数不低于 。
15. (13分)
(13分)
(1)其原因是 。
(2)①应先用 (选填序号)。
②体积分数为 。
(3)作用是 。
(4)理由是 (用化学方程式表示)。
(5)添加M于 (选填序号)。
(6)现象应是 。
(7) 。
20.(12分)决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
A |
578 |
1817 |
2745 |
11578 |
|
B |
738 |
1451 |
7733 |
10540 |
A通常显 ▲ 价,A的电负性 ▲ B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: ▲ 。组成蛋白质的最简单的氨基酸中的碳原子杂化态是 ▲ 。
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图1所示),其中3种离子晶体的晶格能数据如下表:
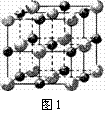 离子晶体 离子晶体 |
NaCl |
KCl |
CaO |
|
晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该 4种离子晶体熔点从高到低的顺序是: ▲ 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的
Mg2+有 ▲ 个。
 (4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 ▲ 。
(5)某配合物的分子结构如右图2所示,其分子内不含有
▲ (填序号)。
A. 离子键 B. 极性键 C. 金属键
D. 配位键 E. 氢 键 F. 非极性键
高二化学期末答卷纸
19. (8分)盐酸利多卡因(F)葡萄糖注射液抗心律失常,可用于急性心肌梗死后室性早搏和室性心动过速。合成路线如下:
(8分)盐酸利多卡因(F)葡萄糖注射液抗心律失常,可用于急性心肌梗死后室性早搏和室性心动过速。合成路线如下:
(1)B在核磁共振氢谱上有 ▲ 种特征峰,C→D的反应类型是 ▲ 。
(2)C的结构简式为 ▲ ;
(3)B的同分异构体种类很多,符合以下条件的B的同分异构体共有 ▲ 种。
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸钠溶液反应可放出CO2气体。
(4)写出 与足量的NaOH溶液共热充分反应的化学方程式: ▲ 。
与足量的NaOH溶液共热充分反应的化学方程式: ▲ 。
18.(8分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 ▲ 、 ▲ 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ▲ ;发生反应的△H ▲ 0(填“>”、“<”或“=”)。
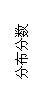
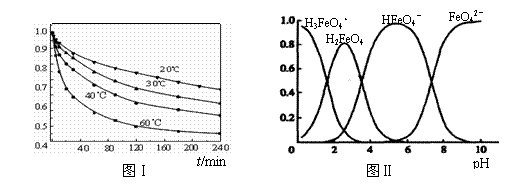
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 ▲ (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
 (4)高铁酸钾还制作可充电电池,原理为:
(4)高铁酸钾还制作可充电电池,原理为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,
写出该电池充电时阳极电极反应式 ▲ 。
17.(13分)三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ▲ ,如何用简单方法判断其已洗涤干净 ▲ 。w ww.k s5u. co m
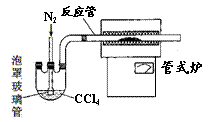
 (2)用右图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50-60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ ▲ 。
(2)用右图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50-60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ ▲ 。
(3)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是 ▲ 。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2(光气),因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 ▲ 。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O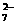 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O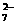 +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为 ▲ 。w ww.k s5u. co m
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 ▲ 。
③样品中无水三氯化铬的质量分数为 ▲ 。
16.(11分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目的是 ▲ 。
(2)完成“氧化除铁”步骤中反应的离子方程式:(在答案纸上把方程式写完整)
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为 ▲ 。
2”的pH时,理论上可选用的最大区间为 ▲ 。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀的pH |
10.4 |
6.4 |
- |
- |
|
沉淀完全的pH |
12.4 |
8.0 |
- |
- |
|
开始溶解的pH |
- |
10.5 |
- |
- |
|
Ksp |
5.6×10-12 |
- |
6.8×10-6 |
2.8×10-9 |
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是 ▲ (选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(5)“滤液4”之后的操作依次为 ▲ 、 ▲ 、过滤、洗涤、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于 ▲ 。
15.(13分)工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 ▲ 。
(2)另称取铁钉6.0g放入15.0mL.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除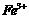 外还可能含有
外还可能含有 。若要确认其中的
。若要确认其中的 ,应用 ▲ (选填序号)。
,应用 ▲ (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性 溶液
溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:

然后加入足量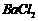 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中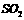 的体积分数为
▲
。
的体积分数为
▲
。
[探究二]
分析上述实验中 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。


(3)装置B中试剂的作用是 ▲ 。
(4)认为 气体Y中还含有Q的理由是
▲
(用化学方程式表示)。
气体Y中还含有Q的理由是
▲
(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 ▲ (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有 ,预计实验现象应是
▲
。
,预计实验现象应是
▲
。
(7)若要测定限定体积气体Y中 的含量(标准状况下约有28mL
的含量(标准状况下约有28mL ),除可用测量
),除可用测量 体积的方法外,可否选用质量称量的方法?做出判断并说明理由
▲
。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由
▲
。
14.镁铝合金5.1g 完全溶于过量的热浓硝酸中,反应中共产生11.2 L NO2(标准状况下测定),若在反应后溶液中加入足量的氢氧化钠溶液,则生成沉淀质量为
A.13.6 g B.7.8g C.5.8g D.4g
第II卷 非选择题(65分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com