
题目列表(包括答案和解析)
20.(13分)研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应 制备SO2气体。
制备SO2气体。
①用简图(下图)在方框中画出制备并收集SO2的实验装置(含试剂)示意图。

②实验过程中,使用分液漏斗滴加浓硫酸的操作是___________________________________。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是__________________________________;
②溴水溶液,现象是__________________________________;
③硫化钠溶液,现象是________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法。
①原因_______________,验证方法______________________________________________。
②原因_______________,验证方法______________________________________________。
江西省高安中学2009-2010学年度下学期期末考试
|
座位号 |
|
|
|
|
19.(16分)研究某一化学反应的实验装置如下图所示:
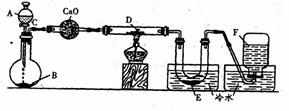
A-F属于下列物质中的六种物质:浓硫酸、浓盐酸、浓氨水、稀硫酸、稀盐酸、稀氟水、水、锌粒、铜片、食盐、高锰酸钾、氯化钙、氧化钙、四氧化三铁、氧化铁、氧化铜、氢气、二氧化碳、二氧化氮、一氧化碳、氯气、氯化氢、氨气、氮气、氧气。
实验现象:
(1)D物质由黑色变为红色
(2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液
(3)点燃的镁条伸入无色无味的F中,镁条表面生成一种灰黄色固体物质。将该发黄色物质放入水中,有气体放出,该气体具有刺激性气味。并能使润湿的红色石蕊试纸变蓝。通过分析回答:
①写出A-F的物质名称:
A_________,B_________,C________,D________,E_______,F______。
②写出有关的化学方程式:
A与B________________________________________________________________________;
C与D________________________________________________________________________;
E与无水硫酸铜________________________________________________________________;
F与Mg________________________________________________________________________;
F与Mg的反应产物与水__________________________________________________________。
18. (13分)A、B、C、X均是中学化学中常见的物质,在一定条件下发生如下转化关系,其中某些副产物已省去。
(13分)A、B、C、X均是中学化学中常见的物质,在一定条件下发生如下转化关系,其中某些副产物已省去。
(1)若X为单质,且X具有氧化性,举例写出A、B、C的化学式。
A_________ B___________ C____________
(2)若X为金属单质,且X具有还原性,举例写出A、B、C的化学式。
A_________ B___________ C____________
(3)若X为NaOH溶液,A、B、C是含有相同金属元素的化合物,写出反应②的离子方程式________。
(4)若A常温下是气体,B、C均是大气污染气体,写出B生成C的化学方程式_________________。
(5)若A在常温下是液态有机物,写出A与C反应生成有水果香味物质的分子式____________。
17.(10分)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:

(1)D的化学式(分子式)是_________,E的化学式(分子式)是_________。
(2)A和B反应生成C的化学方程式是_____________。
(3)E和F反应生成D、H和G的化学方程式是__________________。
16.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是( )
|
|
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
 (标准状况) (标准状况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0mol·L-1 B.能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸未反应完 D.15.7g混合物恰好与盐酸完全反应
15.某碳酸钾样品中的杂质含有纯碱、硝酸钾、硝酸钡中的一种或两种。取7.8g该样品溶于适量水中得到澄清溶液,再加入过量CaCl2溶液得到沉淀5.0g。下列对原样品中所含杂质的判断正确的是( )
A.一定没有Na2CO3和Ba(NO3)2 B.一定有Na2CO3而没有Ba(NO3)2
C.没有Ba(NO3)2,但有KNO3可能还有Na2CO3 D.没有Na2CO3但有Ba(NO3)2和KNO3
14.下列反应的离子方程式书写正确的是( )
A.在氢氧化钙溶液中加入过量小苏打:
B.在氢氧化钾稀溶液中通入过量的二氧化硫气体:
C.过量的铁与浓硝酸反应:
D.Fe2O3溶于过量的氢碘酸溶液中:
13.向含有 、
、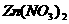 、
、 、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag。下列结论错误的是( )
、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+,同时析出0.1mol Ag。下列结论错误的是( )
A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+的物质的量之比为1:2 D.1mol Fe可还原2mol Fe3+
12.将40mL 1.5 mol·L-1的CuSO4溶液与30mL 3 mol·L-1的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中c(Cu2+)和c(OH-)都已变得很小,可忽略,则生成沉淀的组成可表示为( )
A.Cu(OH)2 B.CuSO4·Cu(OH)2 C.CuSO4·2Cu(OH)2 D.CuSO4·3Cu(OH)2
11.下列有关实验操作中,正确的是( )
A.将新配制的0.1mol/L NaOH溶液转移到干燥洁净、带胶塞的无色细口瓶中
B.向溶液中通入足量的氯气,以除去 溶液中的FeSO4
溶液中的FeSO4
C.在中和滴定实验过程中,目光应密切注视滴定管中的液面变化
D.开启从未使用的浓氨水(新瓶)时,应先充分振荡使氨气溶于水再启瓶塞
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com