
题目列表(包括答案和解析)
21.(8分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 (1)比较下列两组物质的熔点高低(填“>”或“<”
(1)比较下列两组物质的熔点高低(填“>”或“<”
SiC Si; SiCl4 SiO2
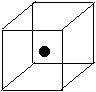
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g) 该反应的反应热△H = kJ/mol.
20.(12分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为_____ _____;
(2)写出与H2O分子互为等电子体的微粒__ ________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_ ____
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
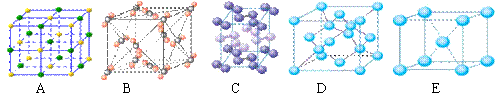
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__ ___(请用相应的编号填写)
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:
。
19.(10分)m、n、x、y四种主族元素在周期表里的相对位置如下图所示。
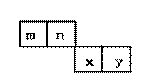 已知它们的原子序数总和为46,则:
已知它们的原子序数总和为46,则:
(1)元素n的气态氢化物的分子式为 ,
空间构型为 。
(2)m与y所形成的化合物含 键,
属 分子。(填“极性”或“非极性”)
(3)x位于周期表的第 周期,第 族;其原子结构示意图为 。
(4)由n、y的氢化物相互作用所生成的物质的电子式为 ,此物质在固态时属于 晶体。
18. (7分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2) 写出C元素基态原子的电子排布式_________________________。
(3) 用轨道表示式表示D元素原子的价电子构型____________________。
(4) 元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”)
17. (7分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
(7分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积为V cm3。
(1)步骤①中仪器A最好使用 (填序号)。
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是用 滴定管,能否用水代替苯 ,理由是
。
(3)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为 。
16.据报道,某种合金材料有较大的储氢容量,其晶体结构
的最小单元如右图所示。则这种合金的化学式为 ( )
A.LaNi6 B.LaNi3 C.LaNi4 D.LaNi5
15. 某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是 ( )
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是 ( )
A.配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl- 和NH3分子均与Pt4+配位
D.配合物中Cl- 与Pt4+配位,而NH3分子不配位
14.下列有关金属的说法正确的是 ( )
A.金属原子的核外电子在金属晶体中都是自由电子
B.镁型和铜型的原子堆积方式空间利用率最高
C.金属原子在化学变化中失去的电子数越多,其还原性越强
D.金属导电的实质是金属阳离子在外电场作用下的定向移动
13.A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形
成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,
单质F是一种重要的半导体材料。则下列推断中不正确的是 ( )
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.原子半径由大到小的顺序是:E>F>C>D
D.五种元素中最高价氧化物对应的水化物酸性最强的是D
12.下列各组离子可能大量共存的是 ( )
A.不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2-
B.能与金属铝反应放出氢气的溶液中: K+、NO3-、Cl-、NH4+
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32-
D.中性透明溶液:K+、HCO3-、NO3-、Fe3+、SO42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com