
题目列表(包括答案和解析)
24.(15分) 化合物A(分子式为C9H9O2Br)在一定条件下有如下的转化关系,其中1mol C与Na完全反应生成1 mol H2,若与NaHCO3完全反应能产生1mol CO2,D和E互为同分异构体,但D可以使溴的四氯化碳溶液褪色,而E分子中有一个苯环和一个五元环。
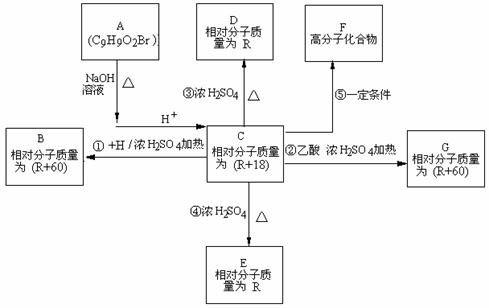
(1)写出A含有官能团的名称: ;
(2)H可能是(写名称):________________________________________________ __;
(3)写出反②、③的反应类型:②__________________、③__________________;
(4)写出E、G的结构简式E G ;
(5)反应⑤的化学方程式:
(6)同时满足下列条件的C的同分异构体有_________ 种:
①能发生银镜反应;
②1mol该物质可以消耗3molNaOH;
③苯环上的一氯代物有3种。
23.(10分)化学原理常应用于工业生产,如氯碱工业和硫酸工业:
(1)氯碱工业用到的设备为离子交换膜电解槽,电解时阳极加入 ___________(填试剂名称),阴极产物为_________________(填化学式),电解的总反应方程式____________________________________________________.
(2)接触法制硫酸主要分成三步,第一步是煅烧黄铁矿,在___________中进行,第二步是催化氧化,发生反应的方程式___________________________________________,
第三步是吸收三氧化硫。取制备的少量硫酸用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液的体积为400mL,放出热量为Q kJ,写出表示该反应中和热的热化学方程式___________________________________________________。
22. (7分))如图是氯化钠的晶胞示意图,回答如下问题:
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。
 A.正四面体 B.正六面体 C.正八面体 D.正十二面体
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
(2) NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,强热使其气化,测的气体体积为5.6 L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取a g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒 B.烧杯 C.容量瓶 D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为b cm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。
(用含V、a、b的代数式表示)
21.(3分)下列有关化学实验操作正确的是_______________(填序号)
①实验室用盛装饱和碳酸钠溶液的试管收集乙酸乙酯
②为证明淀粉水解完全,取少量反应混合物,先加NaOH溶液中和硫酸,再加入新制氢氧化铜悬浊液并加热,有红色沉淀生成。
③验证RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液。
④实验室用无水乙醇和浓硫酸共热制乙烯时,把温度计水银球插入液面以下。
⑤向皂化反应后的溶液中加入食盐,静置后进行分液操作得到肥皂。
20. 如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是
如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是
A.电源B是负极
B.甲乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1︰2︰2︰2
C.欲用丙装置给铜镀银,H应该是Ag,电镀液选择AgNO3溶液
D.装置丁中X极附近红褐色变浅,说明氢氧化铁胶粒吸附正电荷。


 第Ⅱ卷(非选择题,共50分)
第Ⅱ卷(非选择题,共50分)
19.一定质量的铁和铜的混合物,与一定浓度的硝酸反应后容器中没有固体剩余,生成标准状况下2.24LNO和4.48LNO2(不考虑N2O4的存在)的混合气体,则参加反应的HNO3的物质的量是
A.0.5 mol B.0.8 mol C.1.0 mol D.1.6 mol
18.下列说法中正确的是
A、碳化硅的熔点高于金刚石
B、H2O、H2S、H2Se的沸点依次升高
C、分子晶体的熔沸点很低,常温下都呈液态或气态
D、原子晶体中的各相邻原子都以共价键相结合,熔沸点较高
17.分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有 A.1种 B.2种 C.4种 D.8种
16.NH3.H2S等是极性键构成的极性分子,CO2.BF3.CCl4等是极性键构成的非极性分子。根据上述事实,通过比较归纳可推出ABn型分子是非极性分子的经验规律是
A.分子中不含有H原子的分子是非极性分子
B.在ABn分子中A原子的所有价电子都参与成键的是非极性分子
C.ABn分子中每个共价键的键长都相等的分子是非极性分子
D.在ABn分子中A的相对原子质量小于B的相对原子质量时为非极性分子
15.在含FeCl3.FeCl2.AlCl3.NaCl的溶液中,加入足量的Na2O固体,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是
A.Na+ B.Al3+ C.Fe3+ D.Fe2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com