
题目列表(包括答案和解析)
16、一些重要常见气体的性质(物理性质和化学性质)
|
物质 |
物理性质 (通常状况下) |
化学性质 |
用途 |
||||
|
氧气 (O2) |
无色无味的气体,不易溶于水,密度比空气略大 |
|
1、 供呼吸 2、 炼钢 3、 气焊 (注:O2具有助燃性,但不具有可燃性,不能燃烧。) |
||||
|
②S + O2 ==SO2 (空气中-淡蓝色火
|
|||||||
|
|||||||
|
④3Fe + 2O2 == Fe3O4 (剧烈燃烧,火星四射,放出大量的热,生成黑色固体) |
|||||||
|
⑤蜡烛在氧气中燃烧,发出白光,放出热量 |
|||||||
|
氢气 (H2) |
无色无味的气体,难溶于水,密度比空气小,是最轻的气体。 |
①
H2 + Cl2 ==== 2HCl |
1、填充气、飞舰(密度比空气小) 2、合成氨、制盐酸 3、气焊、气割(可燃性)4、提炼金属(还原性) |
||||
|
无色无味的气体,难溶于水,密度比空气小,是最轻的气体。 |
②
H2 + Cl2 ==== 2HCl |
1、填充气、飞舰(密度比空气小) 2、合成氨、制盐酸 3、气焊、气割(可燃性)4、提炼金属(还原性) |
|
||||
③
 还原性: 还原性: H2 + CuO === Cu + H2O H2 + CuO === Cu + H2O 3H2 + WO3 === W + 3H2O 3H2 + WO3 === W + 3H2O3H2 + Fe2O3 == 2Fe + 3H2O |
|
||||||
|
无色无味的气体,密度大于空气,能溶于水,固体的CO2叫“干冰”。 |
CO2 + H2O ==H2CO3(酸性) (H2CO3 === H2O
+ CO2↑)(不稳定) (H2CO3 === H2O
+ CO2↑)(不稳定) |
1、用于灭火(应用其不可燃烧,也不支持燃烧的性质) 2、制饮料、化肥和纯碱 |
|
||||
CO2 + Ca(OH)2 ==CaCO3↓+H2O(鉴别CO2)
|
|
||||||
|
|
||||||
|
CaCO3 == CaO + CO2↑(工业制CO2) |
|
||||||
|
无色无味气体,密度比空气略小,难溶于水,有毒气体 |
①可燃性:2CO + O2 == 2CO2 (火焰呈蓝色,放出大量的热,可作气体燃料) |
1、 作燃料 2、 冶炼金属 |
|
||||
② 还原性: 还原性: CO + CuO === Cu + CO2 CO + CuO === Cu + CO2 3CO + WO3 === W + 3CO2 3CO + WO3 === W + 3CO23CO + Fe2O3 == 2Fe + 3CO2 |
|
||||||
|
(跟血液中血红蛋白结合,破坏血液输氧的能力) |
|
||||||
15、三种气体的实验室制法以及它们的区别:
|
气体 |
氧气(O2) |
氢气(H2) |
二氧化碳(CO2) |
||
|
药品 |
高锰酸钾(KMnO4)或双氧水(H2O2)和二氧化锰(MnO2) [固(+固)]或[固+液] |
锌粒(Zn)和盐酸(HCl)或稀硫酸(H2SO4) [固+液] |
石灰石(大理石)(CaCO3)和稀盐酸(HCl) [固+液] |
||
|
反应原理 |
 2KMnO4 == K2MnO4+MnO2 2KMnO4 == K2MnO4+MnO2
或2H2O2==== 2H2O+O2↑ |
Zn+H2SO4=ZnSO4+H2↑ Zn+2HCl=ZnCl2+H2↑ |
CaCO3+2HCl=CaCl2+H2O+CO2↑ |
||
|
仪器装置 |
P36 图2-17(如14的A) 或P111. 图6-10(14的B或C) |
P111. 图6-10 (如14的B或C) |
P111. 图6-10 (如14的B或C) |
||
|
检验 |
用带火星的木条,伸进集气瓶,若木条复燃,是氧气;否则不是氧气 |
点燃木条,伸入瓶内,木条上的火焰熄灭,瓶口火焰呈淡蓝色,则该气体是氢气 |
通入澄清的石灰水,看是否变浑浊,若浑浊则是CO2。 |
||
|
收集方法 |
①排水法(不易溶于水)
②瓶口向上排空气法(密度比空气大) |
①排水法(难溶于水)
②瓶口向下排空气法(密度比空气小) |
①瓶口向上排空气法 (密度比空气大) (不能用排水法收集) |
||
|
验满 (验纯) |
用带火星的木条,平放在集气瓶口,若木条复燃,氧气已满,否则没满 |
<1>用拇指堵住集满氢气的试管口;<2>靠近火焰,移开拇指点火 若“噗”的一声,氢气已纯;若有尖锐的爆鸣声,则氢气不纯 |
用燃着的木条,平放在集气瓶口,若火焰熄灭,则已满;否则没满 |
||
|
放置 |
正放 |
倒放 |
正放 |
||
|
注意事项 |
①检查装置的气密性 (当用第一种药品制取时以下要注意) ②试管口要略向下倾斜(防止凝结在试管口的小水珠倒流入试管底部使试管破裂) ③加热时应先使试管均匀受热,再集中在药品部位加热。 ④排水法收集完氧气后,先撤导管后撤酒精灯(防止水槽中的水倒流,使试管破裂) |
①检查装置的气密性 ②长颈漏斗的管口要插入液面下; ③点燃氢气前,一定要检验氢气的纯度(空气中,氢气的体积达到总体积的4%-74.2%点燃会爆炸。) |
①检查装置的气密性 ②长颈漏斗的管口要插入液面下; ③不能用排水法收集 |
14、制取气体常用的发生装置和收集装置:
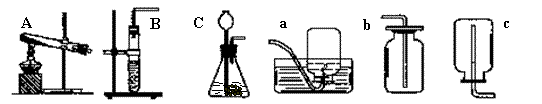 发生装置 发生装置 |
收集装置 |
||||
|
|
|
|
|
|
|
 [固(+固)] [固(+固)] |
[固+液] 简易装置 |
[固+液] |
排水法 |
向上 排空气法 |
向下 排空气法 |
13、
12、原子、分子、离子、元素和物质(纯净物和混合物)间的关系:
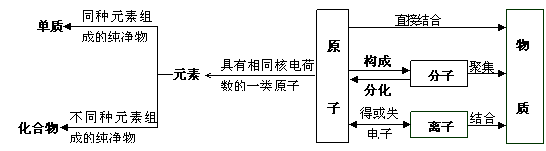

11、化学符号的意义及书写:
(1)化学符号的意义:a.元素符号:①表示一种元素;②表示该元素的一个原子。
b.化学式:本知识点的第5点第(1)小点
c.离子符号:表示离子及离子所带的电荷数。
d.化合价符号:表示元素或原子团的化合价。
 当符号前面有数字(化合价符号没有数字)时,此时组成符号的意义只表示该种粒子的个数。
当符号前面有数字(化合价符号没有数字)时,此时组成符号的意义只表示该种粒子的个数。

(2)化学符号的书写:a.原子的表示方法:用元素符号表示
b.分子的表示方法:用化学式表示
c.离子的表示方法:用离子符号表示
d.化合价的表示方法:用化合价符号表示
|
|
10、物质的结构:
9、 金属活动性顺序表:
金属活动性顺序表:
(钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金)
说明:(1)越左金属活动性就越强,左边的金属可以从右边金属的盐溶液中置换出该金属出来
(2)排在氢左边的金属,可以从酸中置换出氢气;排在氢右边的则不能。
 (3)钾、钙、钠三种金属比较活泼,它们直接跟溶液中的水发生反应置换出氢气
(3)钾、钙、钠三种金属比较活泼,它们直接跟溶液中的水发生反应置换出氢气
8、 酸碱度的表示方法--PH值
酸碱度的表示方法--PH值
说明:(1)PH值=7,溶液呈中性;PH值<7,溶液呈酸性;PH值>7,溶液呈碱性。
(2)PH值越接近0,酸性越强;PH值越接近14,碱性越强;
PH值越接近7,溶液的酸、碱性就越弱,越接近中性。
7、 书写化学方程式的原则:①以客观事实为依据;
②遵循质量守恒定律
书写化学方程式的原则:①以客观事实为依据;
②遵循质量守恒定律
书写化学方程式的步骤:“写”、“配”、“注”“等”。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com