
题目列表(包括答案和解析)
5.某有机物能使溴水褪色,也能在一定条件下发生水解生成两种有机物,还能发生加聚反应生成高分子化合物,则此有机物中一定含有下列基团的组合是
①-CH3;②-OH;③-Cl;④-CHO;⑤-C2H3;⑥-COOH;⑦-COOCH3
A、③⑤ B、②⑥ C、⑤⑦ D、④⑤
4.下列实验中,仪器的下端必须插入液面下的是
①制备氢气的简易装置中的长颈漏斗 ②制备氯气装置中的分液漏斗
③制备Fe(OH)2操作中的胶头滴管 ④将氯气溶于水时的导管
⑤用乙醇制取乙烯时的温度计 ⑥分馏石油时的温度计
A.①③⑤ B.②④⑥ C.①③④⑤ D.全部
3.原子序数依次增大的A、B、C、D、E五种短周期元素。B、C、D位于同一周期相邻位置,B和D的原子最外层电子数之比为2∶3;B、C、D分别与A形成的化合物分子中都含有10个电子;E的原子结构示意图中从内到外各层的电子数之比为1∶4∶1。则下列叙述中正确的是
A.B和D形成的某种化合物能与E的单质在一定条件下发生置换反应
B.实验室制备A和C两种元素形成的化合物发生的反应属于氧化还原反应
C.由B、D原子或A、B原子构成的分子都是非极性分子
D.由A、B、C、D四种元素组成的化合物中不可能含有离子键
2.下列说法中正确的是
A.由非金属元素组成的化合物一定是共价化合物
B.当NO2溶于水产生1molNO时,反应转移的电子数为6×1023个
C.质子数相同的粒子一定属于同种元素
D.在c(H+)=c(OH-)的溶液中,AlO2-不可能大量存在
1.下列说法正确的是( )
A.医疗上常用75%(体积分数)酒精作消毒剂 B.有机食品,就是有机合成的食品
C.加碘食盐中的“碘”通常是指碘化钾 D.使用明矾可软化硬水
21.(10分)在温度为373K时,把0.25moi NO2气体通入体积为500ml的真空密闭容器中,发生反应:2NO2(g)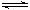 N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则:
N2O4(g) .反应进行到2s时,N2O4含量为0.05mol,进行到60s时,达到该条件下反应的最大限度,此时容器中混合气体的平均相对分子质量为47.5,则:
⑴.开始时2s内以c (NO2)的变化表示的反应速率是多少?
⑵.达到最大限度时体系内的压强是开始的多少倍?

20.(10分)已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ); △H = -571.6 kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比.
19.(10分)在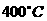 时,将
时,将 和
和 压入一个盛有催化剂的
压入一个盛有催化剂的 密闭容器中进行反应(
密闭容器中进行反应(
 ),2分钟时容器中剩下
),2分钟时容器中剩下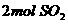 和
和 。则:
。则:
 (1)2分钟内生成的
(1)2分钟内生成的 的物质的量是多少?
的物质的量是多少? 起始的物质的量是多少?
起始的物质的量是多少?
(2)2分钟内以 浓度变化表示的平均反应速率是多少?以
浓度变化表示的平均反应速率是多少?以 浓度变化表示的平均反应速率又是多少?
浓度变化表示的平均反应速率又是多少?
18.(8分)城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭和水蒸气反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式____________________________.
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为
C3H8(g)
+5O2(g) == 3CO2(g)
+ 4H2O(l);△H=–2220.0
kJ· ,
,
又知CO气体燃烧的热化学方程式为:
CO(g)
+1/2O2(g) == CO2(g)
;△H=–282.57kJ· ,
,
试比较同质量的C3H8和CO燃烧,产生的热量比值约为_________:1。
(3)已知氢气燃烧的热化学方程式为2H2(g) + O2(g) ==
2H2O(l);△H=–571.6 kJ· ,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
(4)氢气是未来的能源,除来源丰富之外,还具有的优点是____________________
17. (8分)实验室利用如右图装置进行中和热的测定.请回答下列问题:
(8分)实验室利用如右图装置进行中和热的测定.请回答下列问题:
(1).该图中有两处未画出,它们是 、
.
(2).在操作正确的前提下,提高中和热测定准确性的关键是
____________________ .
(3).做一次完整的中和热测定实验,温度计需使用_______次.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com