
题目列表(包括答案和解析)
26.(8分)有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为_______。
(2)与锌开始反应时产生氢气的速率分别为v1、v2、v3,其大小关系为_______。
(3)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n1 mol,n2 mol,n3 mol,它们的大小关系为____________。
(4)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为____________。
25.(10分)在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内物质的浓度(mol/L)进行分析,得到如下表格:
|
时间/s |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
|
c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_______,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0-20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
24.(10分)计算下列溶液的PH ,并将计算结果填在空格上:
(1)c(H+) = 1×10-4 mol/L的溶液 ;
(2)c(OH-) = 1×10-4 mol/L的溶液 ;
(3)将0.1 mol HCl溶于水制成100 ml溶液 ;
(4)将PH=2的HCl溶液和PH=2的H2SO4溶液以体积比3:1混和
(5)将0.23g金属钠溶于水并配制成100 mL的溶液 。
23. (8分)氨水中存在下列电离平衡:NH3·H2O NH4+
+ OH- 若向氨水中
(8分)氨水中存在下列电离平衡:NH3·H2O NH4+
+ OH- 若向氨水中
(1)加入少量NaOH(s),则平衡向 方向移动;
(2)加入少量浓盐酸, 则平衡向 方向移动;
(3)加水稀释, 则平衡向 方向移动;
(4)欲使平衡向逆方向移动而c(NH4+)增大,则可加入 (填化学式)
22.
(9分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的正反应为_______热反应,且m + n_____ p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若温度、体积一定时加入B,则A的转化率_______、B的转化率_______。
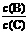 (4)若升高温度,则平衡时B、C的浓度之比 将______ ___。
(4)若升高温度,则平衡时B、C的浓度之比 将______ ___。
(5)若加入催化剂,平衡气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________ ;而维持容器内压强不变,充入氖气再达平衡时,混合物颜色____ _(填“变深”“变浅”或“不变”)。
21.(6分)现有可逆反应:2SO2(g)
+ O2(g)  2SO3(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措施。
2SO3(g),△H<0,试根据下列图象判断t2、t3、t4时刻采取的措施。

t2: ; t3: ; t4: 。
20.某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.16mL稀盐酸 B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管进行中和滴定时,用去某浓度的碱溶液21.70mL
第Ⅱ卷 (共60分)
19.某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g)  cZ(g)+dW(g),
cZ(g)+dW(g),
达平衡后,保持温度不变,压强增大至原来的2倍,当再达到平衡时,W的浓度为
原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. (a+b)< (c+d) C. Z的体积分数变小 D. X的转化率变大
18.相同条件下,等体积、等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,
则所得溶液的体积
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
17、在25℃时,某溶液中,由水电离出的c (H+)=1×10 -12mol/L,则该溶液的pH可能是
A.12 B.7 C.6 D.2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com