
题目列表(包括答案和解析)
1016.5 (2分)
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
 3A(g)+B(g) xC(g)+2D(g),经5min后测得D的浓度为0.5mol/L,
3A(g)+B(g) xC(g)+2D(g),经5min后测得D的浓度为0.5mol/L,
c(A):c(B)=4:5,C的平均反应速率为0.15mol/(L·.min)。试求:
(1)此时A的浓度及反应开始前容器中A、B的物质的量;
(2)B的平均反应速率;
(3)x的值。
24、 B2H6(g)+ 3O2(g)= B2O3(s)+ 3H2O(l)△H=-2165kJ/mol;(2分)
B2H6(g)+ 3O2(g)= B2O3(s)+ 3H2O(l)△H=-2165kJ/mol;(2分)
27、(16分)50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
 ⑴大小烧杯间填满碎泡沫塑料的作用___
。
⑴大小烧杯间填满碎泡沫塑料的作用___
。
⑵ (填“能”或“不能”)将环形玻璃搅拌棒改为环形铜棒。其原因是 。
⑶大烧杯上如不盖硬纸板,对求得中和热数值的影响是
(填“偏高”或“偏低”或“无影响”)。
⑷如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量 __ (“增加”、 “减少”或“不变”),理由是 ;所求中和热数值 (“增加”、“减少”或“不变”),理由是 。
26、(10分)toC时,向某密闭容器中加入1 mol N2和3 mol H2合成NH3,达平衡时测得NH3的体积分数为m,若改变起始加入量,使上述反应平衡后,NH3的体积分数仍为m(N2、H2和NH3的加入量用x、y、z表示)。则x、y、z分别满足
(1)恒温、恒容:
①若x=0,y=0,则z=_____;
②若x=0.75 mol,则y=_____,z=_____;
③x、y、z应满足的一般条件是 ______________________
(2)恒温、恒压:
①若x=0,y=0,则z_____;
②若x=0.75 mol,则y=_____,z_____;
③x、y、z应满足的一般条件是 _____________________
25.(18分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)
 2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号) 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应的活化能降低,加快反应速率
d.活化分子间所发生的碰撞为有效碰撞
e.降低温度,V正、V逆均减小且V正减小的倍数小于V逆减小的倍数。
f.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②据温度对平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是
a.容器内的密度保持不变 b.容器内压强保持不变 c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变 e.容器内混合气体的平均摩尔质量保持不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
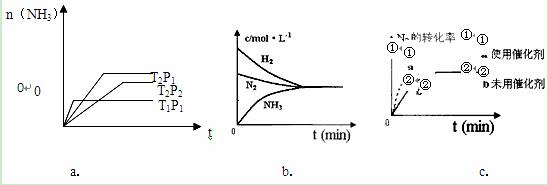
|
|
|
|
|
Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
 23、(4分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
23、(4分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。

图1 图2
取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。写出该反应的离子方程式___________________________________________,在前4min内,镁条与盐酸的反应速率逐渐加快,原因是______________________ __ ,在4min之后,反应速率逐渐减慢,原因是______________________________ 。
24、(4分)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,表示乙硼烷燃烧热的热化学方程式为 ______________________ 。
又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
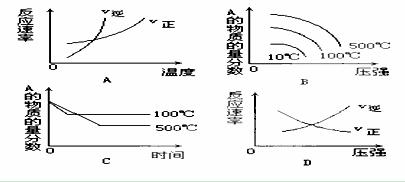
22、对于可逆反应:A(g)+B(g) 3C(g)△H<0下列图象中正确的是( )
3C(g)△H<0下列图象中正确的是( )
第Ⅱ卷( 非选择题 共56分)
21、在一密闭容器中充入1molNO2气体,建立如下平衡:2 NO2 N2O4,
测得NO2转化率为a%.在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得 NO2转化率为b%,a与b比较( )
N2O4,
测得NO2转化率为a%.在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得 NO2转化率为b%,a与b比较( )
A. a>b B.a<b C.a=b D.无法确定
20、 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN-N键吸收193kJ热量,断裂1molN
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂1molN-N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则( )
N键吸收941kJ热量,则( )
A. N4与N2互称为同位素 B. 1molN4气体转化为N2时要吸收748kJ能量
C. N4是N2的同系物 D. 1molN4气体转化为N2时要放出724kJ能量
19、化学反应: C(s)+1/2O2(g) == CO(g) △H1<0
CO(g) +1/2O2(g) == CO2(g) △H2<0
C(s)+O2(g) == CO2(g) △H3<0;
下列说法不正确的是(相同条件下)( )
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.12gC所具有的能量一定大于28gCO所具有的能量
C.△H1+△H2=△H3
D.将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com