
题目列表(包括答案和解析)
9.将等质量的锌粒(wg)分别投入VL pH=2的盐酸和醋酸(含醋酸n mol),结果发现一种溶液中Zn有剩余,有关叙述正确的是( )
A.0.325V<W<32.5n
B.产生H2的平均反应速率盐酸大于醋酸
C.产生H2的量盐酸多于醋酸
D.与醋酸反应时锌有剩余
8.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液( )
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
7.
 某温度时,N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3
某温度时,N2+3H2 2NH3的平衡常数K=a,则此温度下,NH3  H2+
H2+  N2的平衡常数为( )
N2的平衡常数为( )
A.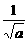 B.
B. C.
C. D.a2
D.a2
6.将pH等于3的强酸溶液和pH等于12的强碱溶液混合,当溶液的pH=11时,强酸与强碱的体积比是( )
A.9:2 B.9:1 C.1:10 D.2:5
5.某学生的实验报告所列出的下列数据合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20gNaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的NaOH溶液21.70mL
4. 下列说法正确的是( )
A.等物质的量的硫固体和硫蒸气分别完全燃烧,后者放出的热量多
B.植物通过光合作用将二氧化碳转化为葡萄糖是太阳能转化为热能的过程
C.在101kPa时,1mol纯物质完全燃烧时所放出的热量叫做该物质的燃烧热
D.热化学方程式中的△H的值与反应物的用量有关
3.在25℃,1.01×105Pa条件下,反应2N2O5(g)===4NO2(g)+O2(g) △H=+56.7kJ/mol能自发进行的合理解释是( )
A.该反应是熵减反应 B.该反应是分解反应
C.该反应的焓变效应大于熵变效应 D.该反应的熵变效应大于焓变效应
2.反应A+B C在温度T1下进行,反应D+E
C在温度T1下进行,反应D+E F在温度T2下进行,已知T2>T1,且D和E的浓度均大于A和B的浓度(其它条件均相同),则两者的反应速率( )
F在温度T2下进行,已知T2>T1,且D和E的浓度均大于A和B的浓度(其它条件均相同),则两者的反应速率( )
A.前者大 B.后者大 C.一样大 D.无法确定
1. 绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、 天然气等;二级能源中的电能、氢能等。下列能源属于绿色能源的是( )
①太阳能 ②风能 ③石油 ④煤 ⑤潮汐能 ⑥木材
A.①②③ B.③④⑤ C.①②⑤ D.④⑤⑥
21.(共16分)
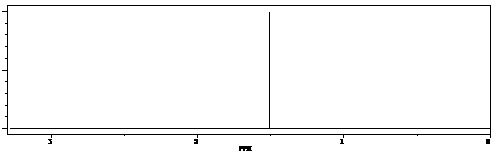 (1)(2分)0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为 。
(1)(2分)0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为 。
(2)(6分)若该烃的核磁共振氢谱如上图所示,则此烃属于 烃,结构简式为 ,名称是 。
(3)(4分)若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2-二甲基丁烷,则此烃结构简式为 ,该烃的核磁共振氢谱中将出现
组峰。
(4)(4分)写出该烃属于(3)中物质类别的主链为4个碳的结构简式。
沈阳铁路实验中学高二化学第一次月考试卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com