
题目列表(包括答案和解析)
6、在室温下,下列等体积的酸和碱溶液混合后,pH一定小于7的是
A、pH=3的HNO3与pH=11的KOH溶液
B、浓度为0.001mol/L的盐酸与pH=11的氨水
C、浓度为0.0005mol/L的硫酸与pH=11的NaOH溶液
D、pH=3的醋酸与pH=11的Ba(OH)2溶液
5、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化图象(图中P表示压强,T表示温度,n表示物质的量):

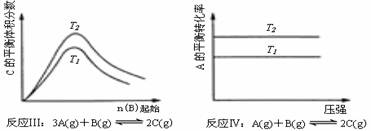
根据以上图象判断,下列叙述不正确的是
A、反应Ⅰ:△H>0,P2<P1
B、反应Ⅱ:△H<0,T1>T2
C、反应Ⅲ:△H>0,T2>T1
D、反应Ⅳ:△H<0,T2<T1
4、某温度下,在一容积可变的恒压密闭容器里,反应3A(g) 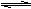 B(g) + 3C(g)
△H<0,
B(g) + 3C(g)
△H<0,
达到平衡时,A、B和C的物质的量分别为6mol、2mol、6mol。在保持温度和压强不变的条
件下,下列说法正确的是
A、充入1 mol氦(He)(He与容器中气体不反应),平衡将向逆反应方向移动
B、充入A、B、C各2 mol,平衡将向正反应方向移动
C、将A、B、C各减少1 mol,C的百分含量增加
D、加入一定量的A气体达平衡后,C的百分含量一定增加
3、下列某无色溶液中,能大量共存的离子组是
A、NH4+、NO3-、I-、H+ B、NO3-、Na+、Ba2+、Ag+
C、Cl-、Cu2+、SO42-、NO3- D、NH4+、NO3-、Al3+、HCO3-
2、20℃时,H2S的饱和溶液,浓度约为0.1mol/L,其电离方程式为:第一步 H2S 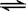
H+ + HS─;第二步 HS─ 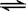 H+
+ S2─。若要使该溶液的pH增大的同时,c(S2─)减小,现有以下措施:①加入NaOH溶液;②加入KCl溶液;③通入适量的SO2气体; ④加入蓝矾晶体;⑤加入浓盐酸。其中采用的措施正确的是
H+
+ S2─。若要使该溶液的pH增大的同时,c(S2─)减小,现有以下措施:①加入NaOH溶液;②加入KCl溶液;③通入适量的SO2气体; ④加入蓝矾晶体;⑤加入浓盐酸。其中采用的措施正确的是
A、①③⑤ B、②④⑤ C、②③ D、③④⑤
1、在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g) 2Z(g) 不能说明该反应已达到平衡的标志是 ( )
2Z(g) 不能说明该反应已达到平衡的标志是 ( )
A、容器内X、Y、Z的物质的量浓度之比为1︰2︰2
B、容器内各物质的物质的量浓度不随时间变化
C、容器内气体的压强不随时间变化
D、单位时间消耗0.1mol X同时消耗0.2mol Z
25.(12分)
用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
⑴准确称量8.2g含有少量中性易容杂质的样品,配成500ml待测溶液。称量时样品可放在 称量。
A.小烧杯中 B.洁净纸片上 C. 托盘上
⑵滴定过程中眼睛应注视 ;在铁架台上掂一张白纸,其目的是
⑶根据下表数据,计算被测烧碱样品的纯度是 。
|
滴定次数 |
待测溶液的体积(ml) |
标准盐酸(0.2000mol/L)体积 |
|
|
滴定前的刻度(ml) |
滴定后的刻度(ml) |
||
|
第一次 |
10.00 |
0.40 |
20.50 |
|
第二次 |
10.00 |
4.10 |
24.00 |
⑷下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
① 观察酸式滴定管液面时,开始时俯视,滴定终点平视,则滴定结果
② 若将锥形瓶用待测液润洗,然后再加入10.00ml待测液,则滴定结果
林口县第四中学2010-2011学年度上学期期中考试
24.(8分)
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间(s) K^S*5U.C#O% |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)(mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)(mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
23.(10分)
在一定条件下,xA + yB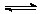 zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
⑴若A、B、C都是气体,减压后向逆反应方向移动,则x、y、z之间的关系是 。
⑵已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动,且A、B的状态中至少有一种是_____________________。
⑶若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为 。
⑷加热后C的百分含量减少,则正反应是 反应(填“吸热”或“放热”)。
22.(10分)
在100℃时,将0.200 mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
|
时间 |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
|
c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0-20s时间段内,四氧化二氮的平均反应速率为________mol×L-1×s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com