
题目列表(包括答案和解析)
16、将0.2mol.L-1HCN溶液和0.1mol.L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
A.c(HCN)<c(CN-) B.c(Na+)> c(CN-)
C.c(HCN)-c(CN-)= c(OH-) D.c(HCN)+ c(CN-)=0.2mol .L-1
15、甲. 乙两容器都发生反应2A
(g )+B(g) xC(g)
,两容器温度和初始压强都相同,甲容器中充入2molA和1molB达到平衡,C在平衡混合气体中体积分数为w物质的量为n1,乙容器中充入1.4molA. 0.7molB和0.6molC,达到平衡后,C的体积分数仍为w物质的量为n2下列说法中正确的是( )
xC(g)
,两容器温度和初始压强都相同,甲容器中充入2molA和1molB达到平衡,C在平衡混合气体中体积分数为w物质的量为n1,乙容器中充入1.4molA. 0.7molB和0.6molC,达到平衡后,C的体积分数仍为w物质的量为n2下列说法中正确的是( )
A. 若甲乙容器均为恒容容器,则x必定等于2
B. 若甲乙容器均为恒压容器,则x必定等于3
C. 若甲为恒压容器,乙为恒容容器,且x不等于3则n1必定小于n2
D. 若甲为恒容容器,乙为恒压容器,且x等于3则n1必定小于n2
14、把NH4I置于密闭容器中,某温度下发生反应:NH4I(s)
 NH3 (g) +
HI (g ),HI (g )
NH3 (g) +
HI (g ),HI (g )  H2(g) +
I2 (g),当反应达到平衡时,C(H2)=0.5mol/L
,C(HI)=4mol/L则容器中NH3、HI、I2的物质的量之比为( )
H2(g) +
I2 (g),当反应达到平衡时,C(H2)=0.5mol/L
,C(HI)=4mol/L则容器中NH3、HI、I2的物质的量之比为( )
A. 8:8:1 B. 2:2:1 C. 3:2:1 D. 10:8:1
13、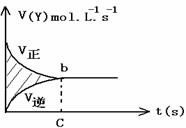 在容积为4L的密闭容器中,进行可逆反应 X(g)+ 2Y(g)
在容积为4L的密闭容器中,进行可逆反应 X(g)+ 2Y(g) 2Z(g)在此过程中,以Y的物质的量浓度表示的反应速率如图,则阴影部分面积表示( )
2Z(g)在此过程中,以Y的物质的量浓度表示的反应速率如图,则阴影部分面积表示( )
A. X物质的量浓度的减少
B. Y的物质的量浓度的减少
C. Z物质的量浓度的增加
D. X的物质的量的减少
12、甲酸和乙酸都是弱酸,当它们的浓度均为0.1mol/L时甲酸中的C(H+)是乙酸中C(H+)的3倍,现有两种浓度不等的甲酸溶液a. b以及0.1mol/L的乙酸溶液,经测定pH值从大到小的顺序为a. 乙酸. b,由此可知 ( )
A. a的浓度必定小于乙酸的浓度 B. a的浓度必定大于乙酸的浓度
C. b的浓度必定小于乙酸的浓度 D. b的浓度必定大于乙酸的浓度
11、在FeCl3和AlCl3的混合溶液中先加入过量的KI溶液,再加入足量的Na2S溶液,最终所得到的沉淀是
A、Fe(OH)3和Al(OH)3 B、S、Al(OH)3和Fe(OH)3
C、Al2S3和I2 D、S、FeS和Al(OH)3
10、下列说法正确的是
A.室温下,某溶液中由水电离出的c(H+)=10-6mol·L-1,则此溶液可能是稀盐酸。
B.等体积、等物质的量浓度的NaHCO3和Na2CO3溶液中,阴离子总数相等。
C.室温下,某溶液中由水电离出的c(H+)=10-10mol·L-1,则此溶液的pH为10或4。
D.0.1mol·L-1 NH4Cl和0.1molL-1 NH4HSO4两溶液相比,前者溶液中c(NH4+)大。
9、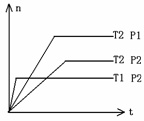 反应2X(g) + Y(g)
反应2X(g) + Y(g)  2Z(g)(正反应放热),在不同温度(T1. T2)及压强(P1.
P2)下,产物的物质的量(n)与时间的关系图如下,则以下判断正确的是
( )
2Z(g)(正反应放热),在不同温度(T1. T2)及压强(P1.
P2)下,产物的物质的量(n)与时间的关系图如下,则以下判断正确的是
( )
A. T1<T2 P1<P2
B. T1<T2 P1>P2
C. T1>T2 P1>P2
D. T1>T2 P1<P2
8、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度但不影响生成H2的总量,可向盐酸中加入适量的
①NaOH(s) ②CaCO3(s) ③ CH3COONa(s) ④ NH4Cl(s) ⑤ CuSO4(s)
⑥ H2O ⑦Na2SO4溶液 ⑧ KNO3溶液 ⑨NaAlO2溶液
A、 ③⑥⑧ B、②⑦⑨ C、③⑥⑦ D、①④⑤
7、为了更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,
AG=lg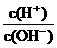 . 下列叙述正确的是
. 下列叙述正确的是
①任何温度下,水的AG等于0
②溶液的AG越小,酸性越强
③常温下,0.1mol/L盐酸的AG=12
④25℃时,某溶液的AG=-10,其pH=10
A、①② B、②④ C、①③ D、③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com