
题目列表(包括答案和解析)
27.(14分)化学能和电能的相互转化,是能量转化的重要方式之一,下图两个实验装置是实现化学能和电能相互转化的装置。
(1)把化学能转化为电能的装置是 (填“甲”或“乙”)
(2)④电极上的电极反应式为
(3)①电极上的电极反应式
 检验该电极反应产物的方法是
检验该电极反应产物的方法是
(4)甲、乙两装置电极附近的溶液首先变红的电极分别是 、 (填序号)
(5)写出装置甲的反应总方程式
26.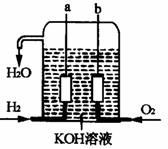 (5分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
(5分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。
a极是 极,b极是 极,
负极反应式为: 。
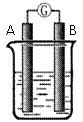
25.(8分)某研究性学习小组欲探究原电池的形成条件,按右图所示装置进行实验并得到下表实验结果:
|
实验 序号 |
A |
B |
烧杯中的液体 |
 灵敏电流计指 灵敏电流计指针是否偏转 |
|
1 |
Zn |
Cu |
稀硫酸 |
有 |
|
2 |
Zn |
Cu |
乙醇 |
无 |
|
3 |
Cu |
C |
氯化钠溶液 |
有 |
|
4 |
Mg |
Al |
氢氧化钠溶液 |
有 |
分析上述数据,回答下列问题:
(1)实验1中电流由 极流向 极(填“A”或“B”)
(2)实验4中电子由B极 流向A极 ,表明负极是 电极(填“镁”或“铝”)
(3)实验3 表明
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是会发生的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)
24.(6分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256KJ的热量。反应的热化学方程式为 。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是a kJ·mol-1,H-H键的键能是b kJ·mol-1;N-H键的键能是c kJ·mol-1。由N2和H2合成1mol NH3时可放出 kJ的热量。
23.(3分)在密闭容器中进行可逆反应,A与B反应生成C,其反应速率可分别用v(A)、v(B)、v(C)表示,且有如下关系:v(B)=3v(A),v(C)=2v(A),3v(C)=2v(B),则该反应的化学方程式为:
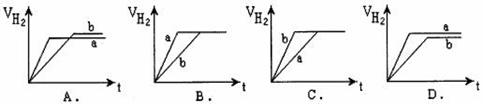
22.等质量的两份锌粉a、b分别加入到两份质量相同的过量的稀硫酸中,同时向a中加入少量的CuSO4溶液,b保持不变,下列各图是产生H2的体积V(L)与时间t(min)的关系,其中正确的是( )
第Ⅱ部分(非选择题 共56分)
21.在C(s)+CO2(g)  2CO(g)反应中,可使反应速率增大的措施是( )
2CO(g)反应中,可使反应速率增大的措施是( )
①增大压强 ②增加碳的量 ③通入CO2 ④恒压下充入N2
⑤恒容下充入N2 ⑥通入CO
A. ①③④ B.②④⑥ C.①③⑥ D.③⑤⑥
20.已知:2H2(g)+O2(g)=2H2O (1),△H=-571.6 kJ·mol-1,下列叙述正确的是( )
A.2mol H2完全燃烧生成水时放出571.6 kJ的热量
B.1mol 液态水完全分解生成H2和O2时放出285.8kJ的热量
C.2个氢分子和1个氧分子完全燃烧生成液态水时放出571.6 kJ的热量
D.上述热化学方程式可表示为H2(g)+ 1/2O2(g)=H2O (1),△H=-285.8 kJ·mol-1
19.在一定条件下,CO和CH4燃烧的热化学方程式分别为:
2CO(g) + O2(g) = 2CO2(g);△H =-566kJ/mol
CH4(g) + 2O2(g) = CO2(g) + 2H2O(l);△H =-890kJ/mol
由1molCO和3molCH4组成的混和气在上述条件下完全燃烧时,释放的热量为( )
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
18.在体积可变的容器中发生反应N2 + 3H2  NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
D.分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com