
题目列表(包括答案和解析)
5.下列物质中最易被酸雨腐蚀的是( )
A、铜像 B、大理石雕塑 C、水泥路面 D、铝制窗台
4.在污染环境的有害气体中,主要由于跟血红蛋白结合而引起中毒的是:( )
A、SO2 B、CO2 C、NO2 D、CO
3.垃圾资源化的方法是:( )
A.填埋 B.焚烧 C.堆肥法 D.分类回收法
2.我国城市环境中的大气污染物主要是:( )
A、O、Cl2、HCl、酸雨 B、SO2、NO2、CO、烟尘
C、NH2、CO、CO2、雾 D、HCl、SO2、N2、粉尘
1.下列说法中,在科学上没有错误的是( )。
A.吸带过滤嘴的香烟,对人体无害 B.保护环境就是保护人类自己
C.纯天然物质配成的饮料,不含任何化学物质 D.水可以变为油
23.(10分)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
试回答下列问题:
(1)平衡时CO的转化率为 ,该反应的化学平衡常数为 。
(2)如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
(3)427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果判断该反应的△H 0(填“>”、“=”、“<”)。
2010--2011学年度第一学期期中考试五校联考
22. (10分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
则△H1、△H2、△H3、△H4的数学关系式是 。
21.(15分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
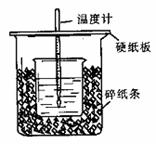
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)要重复进行三次实验的目的是 。
(4)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是_______ 。
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会 ;(填“偏大、偏小、无影响”)。
(7)三次平行操作所测得的数据如下:
|
温度 序号 |
起始温度t1/℃ |
终止温度 T2/℃ |
温度差 △t/℃ |
||
|
HCl |
NaOH |
平均值 |
|||
|
1 |
25 |
25 |
|
27.3 |
|
|
2 |
25 |
25 |
|
27.4 |
|
|
3 |
25 |
25 |
|
28.6 |
|
若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),则实验测得的中和热为 。
20.将一定量的固体Ag2SO4置于容积不变的密闭容器中(装有少量V2O5),在一定温度下发生下列反应:① Ag2SO4(s) Ag2O(s)+SO3(g),② 2SO3(g)
Ag2O(s)+SO3(g),② 2SO3(g) 2SO2(g)+O2(g),反应经过10min后达到了平衡状态,测得c (SO3)=0.4mol/L,c (SO2)=0.1mol/L,则下列叙述中不正确的是
2SO2(g)+O2(g),反应经过10min后达到了平衡状态,测得c (SO3)=0.4mol/L,c (SO2)=0.1mol/L,则下列叙述中不正确的是
A.容器里气体的密度为40g/L
B.在这10min内氧气的平均反应速率为0.05mol/(L·min)
C.反应②中SO3的分解率为20% D.此温度下反应①的平衡常数为4
增城中学2010~2011学年度第一学期期中考试
高二级理科(化学)(第II卷 共35分)
19.反应A(g)+B(g) C(g)
+D(g)过程中的能量变化如图所示,则下列说法正确的是
C(g)
+D(g)过程中的能量变化如图所示,则下列说法正确的是
 A.该反应是放热反应
A.该反应是放热反应
B.反应体系中加入催化剂对反应热有影响
C.当反应达到平衡时,升高温度,A的转化率减小
D.改变压强与加催化剂对反应的影响原因相同,都不会使平衡发生移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com