
题目列表(包括答案和解析)
9、 金属活动性顺序表:
金属活动性顺序表:
(钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金)
说明:(1)越左金属活动性就越强,左边的金属可以从右边金属的盐溶液中置换出该金属出来
(2)排在氢左边的金属,可以从酸中置换出氢气;排在氢右边的则不能。
 (3)钾、钙、钠三种金属比较活泼,它们直接跟溶液中的水发生反应置换出氢气
(3)钾、钙、钠三种金属比较活泼,它们直接跟溶液中的水发生反应置换出氢气
8、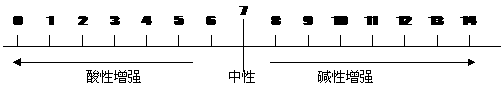 酸碱度的表示方法--PH值
酸碱度的表示方法--PH值
说明:(1)PH值=7,溶液呈中性;PH值<7,溶液呈酸性;PH值>7,溶液呈碱性。
(2)PH值越接近0,酸性越强;PH值越接近14,碱性越强;
PH值越接近7,溶液的酸、碱性就越弱,越接近中性。
7、 书写化学方程式的原则:①以客观事实为依据;
②遵循质量守恒定律
书写化学方程式的原则:①以客观事实为依据;
②遵循质量守恒定律
书写化学方程式的步骤:“写”、“配”、“注”“等”。
6、课本P73. 要记住这27种元素及符号和名称。
核外电子排布:1-20号元素(要记住元素的名称及原子结构示意图)
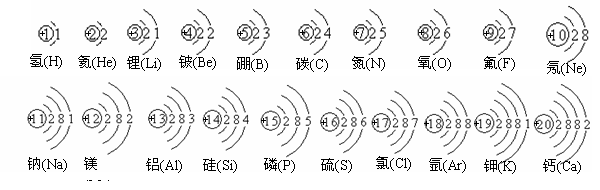
排布规律:①每层最多排2n2个电子(n表示层数)
|
③先排满内层再排外层
注:元素的化学性质取决于最外层电子数
|
金属元素 |
原子的最外层电子数< 4,易失电子,化学性质活泼。 |
|
非金属元素 |
原子的最外层电子数≥
4,易得电子,化学性质活泼。 |
|
稀有气体元素 |
原子的最外层有8个电子(He有2个),结构稳定,性质稳定。 |
4、常见的酸根或离子:SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、ClO3-(氯酸)、
|
HCO3-(碳酸氢根)、HSO4-(硫酸氢根)、HPO42-(磷酸氢根)、
H2PO4-(磷酸二氢根)、OH-(氢氧根)、HS-(硫氢根)、S2-(硫离子)、
NH4+(铵根或铵离子)、K+(钾离子)、Ca2+(钙离子)、Na+(钠离子)、
Mg2+(镁离子)、Al3+(铝离子)、Zn2+(锌离子)、Fe2+(亚铁离子)、
Fe3+(铁离子)、Cu2+(铜离子)、Ag+(银离子)、Ba2+(钡离子)
各元素或原子团的化合价与上面离子的电荷数相对应:见课本
一价钾钠氢和银,二价钙镁钡和锌;
一二铜汞二三铁,三价铝来四价硅。(氧-2,氯化物中的氯为 -1,氟-1,溴为-1)
(单质中,元素的化合价为0 ;在化合物里,各元素的化合价的代数和为0)
|
(1)化学式的意义:①宏观意义:a.表示一种物质;
b.表示该物质的元素组成;
②微观意义:a.表示该物质的一个分子;
b.表示该物质的分子构成;
③量的意义:a.表示物质的一个分子中各原子个数比;
b.表示组成物质的各元素质量比。
(2)单质化学式的读写
|
b.固态非金属。如:碳C 硫S 磷P 等
c.稀有气体。如:氦(气)He 氖(气)Ne 氩(气)Ar等
②多原子构成分子的单质:其分子由几个同种原子构成的就在元素符号右下角写几。
如:每个氧气分子是由2个氧原子构成,则氧气的化学式为O2
|
F2(氟气)、Cl2(氯气)、Br2(液态溴)
多原子分子单质化学式:臭氧O3等
(3)化合物化学式的读写:先读的后写,后写的先读
①两种元素组成的化合物:读成“某化某”,如:MgO(氧化镁)、NaCl(氯化钠)
②酸根与金属元素组成的化合物:读成“某酸某”,如:KMnO4(高锰酸钾)、K2MnO4(锰酸钾)
MgSO4(硫酸镁)、 CaCO3(碳酸钙)
(4)根据化学式判断元素化合价,根据元素化合价写出化合物的化学式:
①判断元素化合价的依据是:化合物中正负化合价代数和为零。
②根据元素化合价写化学式的步骤:
a.按元素化合价正左负右写出元素符号并标出化合价;
b.看元素化合价是否有约数,并约成最简比;
c.交叉对调把已约成最简比的化合价写在元素符号的右下角。
3、其它常见气体的化学式:NH3(氨气)、CO(一氧化碳)、CO2(二氧化碳)、CH4(甲烷)、
SO2(二氧化硫)、SO3(三氧化硫)、NO(一氧化氮)、
NO2(二氧化氮)、H2S(硫化氢)、HCl(氯化氢)
2、主要的空气污染物:NO2 、CO、SO2、H2S、NO等物质
1、空气的成分:氮气占78%, 氧气占21%, 稀有气体占0.94%,
二氧化碳占0.03%,其它气体与杂质占0.03%
⑴ Ca(OH)2+CO2 = CaCO3↓+H2O ⑵ 2NaOH+CuSO4 = Cu(OH)2↓+Na2SO4
白色沉淀 蓝色沉淀
⑴氢气做还原剂: H2 + CuO △ Cu + H2O; 3H2+Fe2O3 高温 2Fe+3H2O
⑵碳做还原剂: C+2CuO 高温 2Cu+CO2↑; 3C+2Fe2O3 高温 4Fe+3CO2↑
⑶一氧化碳做还原剂:CO+CuO △ Cu+CO2; 3CO+Fe2O3 高温 2Fe+3CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com