
题目列表(包括答案和解析)
4.用3g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是: ①再加入30mL3mol/L盐酸 ②改用30mL6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度
A.①②④ B.②③④ C.①③④ D.①②③
3.以下反应最符合绿色化学原子经济性要求的是
A.乙烯聚合为聚乙烯高分子材料 B.甲烷与氯气制备一氯甲烷
C.以铜和浓硝酸为原料生产硝酸铜 D.用SiO2制备高纯硅
2.右下图表示4-溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是
 A.①④
A.①④
B.③④
C.②③
D.①②
1.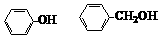 下列物质属于同系物的是
下列物质属于同系物的是
A.CH3CH2CH2OH与CH3OH B. 与
C.乙酸与HCOOCH3 D.CH3CH2Cl与CH3CH2CH2Br
26、(13分)(Ⅰ)(1)原电池 (1分) (2)2Cl- - 2e-= Cl2↑(1分) 6.4g (2分)
(3)颜色不变 (2分)
(Ⅱ)(1) 铂(1分)
Na2SO4 (1分) 4OH--4e- = 2H2O+O2↑(2分)(写2H2O-4e-
= O2↑+4H+ 同样给分) (2) NaCl(1分) 2NaCl+2H2O 2NaOH+H2↑+Cl2↑(2分)
2NaOH+H2↑+Cl2↑(2分)
(没写“电解”或“通电”不给分)

25、(10分)(1)Zn(或锌) 正极(2分)
(2)Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率 (2分) b(2分)
(3)2H++2e-=H2↑(2分)(写2H2O+2e- = H2↑+2OH-不得分,因为“酸化”) 87g (2分)
24、(5分)(1)在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ(没写“在450℃时”得1分,没写温度通常是指“25℃”);(2分)
(2)2CO (g) + SO2 (g)=S (s) +2CO2 (g) △H=-270kJ/mol(3分)(错任何一处不得分)
28、(12分) 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) 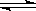 CH3OH(g)。根据题意完成下列各题:
CH3OH(g)。根据题意完成下列各题:
(1) 判断该反应达到平衡状态的标志是 。(填字母)
a.CO和CH3OH浓度相等
 b.CO百分含量保持不变
b.CO百分含量保持不变
c.容器中气体的压强不变
d.CH3OH的生成速率与CO的消耗速率相等
e.容器中混合气体的密度保持不变
(2) 欲提高CO的转化率,下列措施可行的是
。(填字母)
a.向装置中再充入N2 b.向装置中再充入H2
c.改变反应的催化剂 d.升高温度
(3) 反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4) 在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(5) 在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大

27、(10分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
|
实验编号 |
反应物 |
催化剂 |
|
① |
10mL 2% H2O2溶液 |
无 |
|
② |
10mL 5% H2O2溶液 |
无 |
|
③ |
10mL 5% H2O2溶液 |
1mL 0.1mol·L-1FeCl3溶液 |
|
④ |
10mL 5% H2O2溶液+少量HCl溶液 |
1mL 0.1mol·L-1FeCl3溶液 |
|
⑤ |
10mL 5% H2O2溶液+少量NaOH溶液 |
1mL 0.1mol·L-1FeCl3溶液 |
(1) 催化剂能加快化学反应速率的原因是_ _______________。
(2) H2O2具有强氧化性,但遇到氧化性更强的KMnO4时,H2O2表现出还原性,因此H2O2的质量分数可用已知浓度的酸性KMnO4溶液测定,写出该反应的离子方程式_______________________________________。
(3) 实验①和②的目的是________________________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是
__________________ 。
(4) 实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析上图能够得出的实验结论是
______________ _ 。

26、(13分)(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲装置的名称是____________ (填“原电池”或“电解池”)。
(2) 写出电极反应式: pt极______ ______;
当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________________;
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色___________(填“变深”、“变浅”或“无变化”)。
(Ⅱ)由Cu2+、Cl- 、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铜电极、铂电极进行电解实验。
(1)要使电解过程中溶质的组成和质量不变,而该稀溶液的浓度增大,又无浑浊,应以______为阳极电解________溶液,阳极电极反应式为_________________________________。
(2)以铂作阳极电解 ________ 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解的总反应式为 ________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com