
题目列表(包括答案和解析)
20.化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如右图所示,计算反应4~8min间的平均反应速率和推测反应16min时反应物的浓度,结果应是
A.2.5μmol·L-1·min-1和2.0μmol·L-1
B.2.5μmol·L-1·min-1和2.5μmol·L-1
C.3.0μmol·L-1·min-1和3.0μmol·L-1
D.5.0μmol·L-1·min-1和3.0μmol·L-1
19. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq);某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
I3-(aq);某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
A.反应 I2(aq)+I-(aq) I3-(aq)的△H>0[来
I3-(aq)的△H>0[来
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2
C.若反应进行到状态D时,一定有v正>v逆
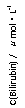
 D.状态A与状态B相比,状态A的c(I2)大
D.状态A与状态B相比,状态A的c(I2)大
18.已知: 2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O (l),若实验测得反应放热3695kJ。则原混合气体中H2与CH4的物质的量之比是
A.1︰1 B.1︰3 C.1︰4 D.2︰3
17.某溶液中,则水电离出的c(OH-)=1×10-13mol/L,此溶液中,一定可以大量共存的离子组是
A.Al3+、Na+、NO3-、Cl- B.K+、Ba2+、Cl-、NO3-
C.K+、Na+、Cl-、HCO3- D.K+、NH4+、SO42-、NO3
16.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
15.某温度时,纯水中c(H+)=10-6mol/l;那么,下列说法正确的是
A、该温度下,纯水显酸性
B、该温度下,0.01mol/l的氢氧化钠溶液的pH=10;
C、该温度下,pH=2的盐酸与pH=12氢氧化钠溶液等体积混合后,混合液呈中性
D、该温度下,水的离子积常数KW=10-14
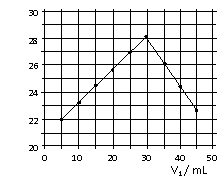
14.将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0mol/L
D.该实验表明有水生成的反应都是放热反应
13.一定温度下,反应: A(g) + 3B(g)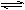
 2C(g) 达到平衡状态的标志是
2C(g) 达到平衡状态的标志是
 A、C的浓度等于A的浓度的两倍
A、C的浓度等于A的浓度的两倍
B、A、B、C的物质的量之比为1 : 3 : 2.
C、A与B不再化合生成C
D、混合气体的总物质的量不随时间变化
12.在密闭容器中进行如下反应:X2(g)+Y2(g)
 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·Lˉ1、0.3 mol·Lˉ1、0.2 mol·Lˉ1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·Lˉ1、0.3 mol·Lˉ1、0.2 mol·Lˉ1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.3 mol·Lˉ1 B.Y2为0.4 mol·Lˉ1
C.X2为0.2 mol·Lˉ1 D.Z为0.4 mol·Lˉ1
11.在25℃时,用蒸馏水稀释1 mol/L氨水至0.01mol/L,随溶液的稀释,下各项中始终保持增大趋势的是 B
A.c(OH-)/c(NH3·H2O) B.c(NH4+)·c(OH-)
C.c(NH3·H2O)/c(NH4+) D.c(OH-)·c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com