
题目列表(包括答案和解析)
18.反应:L(s)+aG(g) bR(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
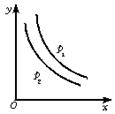
①.上述反应是放热反应 ②.上述反应是吸热反应 ③.a>b ④.a<b
A. ①② B. ②③ C. ①③ D. ②④
17.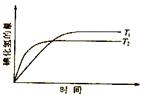 在密闭的容器中进行如下的反应:H2(g)+I2(g)
在密闭的容器中进行如下的反应:H2(g)+I2(g) 2HI(g),在温度T1和T2时,产物的量与时间的关系如右图所示,符合图象的正确的判断是
2HI(g),在温度T1和T2时,产物的量与时间的关系如右图所示,符合图象的正确的判断是
A.T1>T2,△H>0 B.T1>T2,△H<0
C.T1<T2,△H>0 D.T1<T2,△H<0
16.高温下,某反应达平衡,平衡常数K=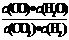 .恒容时,温度升高,H2浓度减小。下列说法正确的是
.恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应化学方程式为:CO+H2O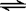 CO2+H2
CO2+H2
15.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 2C(g)
2C(g)
若经 2 s(秒)后测得 C 的物质的量为 1.2 mol ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.15 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.3 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为30%
④ 2 s 时物质 B 的 物质的量浓度为 0.7 mol·L-1
物质的量浓度为 0.7 mol·L-1
其中正确的是
A.①③
B.①④
C.② ③
D.③④
③
D.③④
14.0℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) 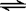 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
①烧瓶内气体的压强不再变化②烧瓶内气体的质量不再变化③NO2的物质的量浓度不再改变④烧瓶内气体的颜色不再加深⑤烧瓶内气体的平均相对分子质量不再变化⑥烧瓶内气体的密度不再变化。
A.①④
 B.③④⑤
C.②⑥
D.全部都可以
B.③④⑤
C.②⑥
D.全部都可以
13. 如下图所示的实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol·
如下图所示的实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol· ,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是
,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是
A.产生气体的体积:①>②
B.Cu电极上放出的气体在标准状况下的体积为224ml
C.溶液的pH变化:①增大,②减小
D.电极反应式①中阳极: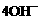
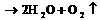 +4 e-
+4 e-
②中负极: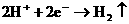
12.S(单斜)和S(正交)是硫的两种同素异形体。

























 已知:① S (单斜,s)+O2(g)
=== SO2(g) △H1=-297.16 kJ·mol-1
已知:① S (单斜,s)+O2(g)
=== SO2(g) △H1=-297.16 kJ·mol-1
 ② S (正交,s)+O2(g)
=== SO2(g) △H2=-296.83 kJ·mol-1
② S (正交,s)+O2(g)
=== SO2(g) △H2=-296.83 kJ·mol-1
 ③ S (单斜,s) === S (正交,s)
△H3
③ S (单斜,s) === S (正交,s)
△H3
 下列说法正确的是
下列说法正确的是
 A.△H3=-0.33 kJ·mol-1
A.△H3=-0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
 C.S(单斜,s)=== S(正交,s) △H3<0,单斜硫比正交硫稳定
C.S(单斜,s)=== S(正交,s) △H3<0,单斜硫比正交硫稳定
 D.S(单斜,s)=== S(正交,s) △H3>0,单斜硫比正交硫稳定
D.S(单斜,s)=== S(正交,s) △H3>0,单斜硫比正交硫稳定
11.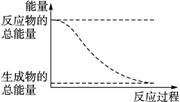 下列变化为放热反应的是( )
下列变化为放热反应的是( )
A.H2O(g) ==H2O(l) ΔH==- 44.0 kJ·mol-1
B.2HI(g) ==H2(g)+I2(g) ΔH==+14.9kJ·mol-1
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如右图所示的化学反应
10.对于可逆反应:C(s)+CO2 (g) 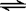 2CO(g),在一定温度下其平衡常数为K,下列条件的变化中,能使K发生改变的是
2CO(g),在一定温度下其平衡常数为K,下列条件的变化中,能使K发生改变的是
A.将C的量 B.升高温度
C.增大压强 D.使用合适催化剂
9.将铂丝插入KOH溶液作电极,然后向两个电极上分别通入氢气和氧气,可以形成原电池,由于发生的反应类似于氢气的燃烧,所以称作氢氧燃料电池。下列说法正确的是
A. 充入氢气的一极为负极 B. 正极发生氧化反应
C. 燃料电池的能量转化率可以达到100% D. 负极反应式:H2 →2H++2 e-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com