
题目列表(包括答案和解析)
25.(9分)如右图装置闭合电键时,电流计A的指针将发生偏转。试回答:
(1)A池是 (填“原电池”或“电解池”)
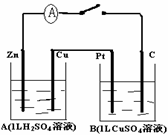 Cu的电极名称是
Cu的电极名称是
(2)B池中的总反应化学方程式是______ ;
若此过程中有0.02mol电子通过,则B中两极的
质量差最多是 g(四个电极质量相同),
B溶液的PH将 (填“变大”或“变小”).
 (3)如果要用B池给铁片上镀上一层Cu,则B池应作何改进
26.(14分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:
,10s时,测得A的物质的量为1.7mol,C的
(3)如果要用B池给铁片上镀上一层Cu,则B池应作何改进
26.(14分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:
,10s时,测得A的物质的量为1.7mol,C的
反应速率为0.0225mol·L-1·s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x =
(2)从反应开始到10s,B的平均反应速率为
(3)从反应开始到40s达平衡状态,A的平均反应速率为
(4)平衡时容器中B的体积分数为
(5)该温度下此反应的平衡常数表达式为 数值是
(6)下列各项能表示该反应达到平衡状态是
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量 n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
24. (6分)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳。然后是使得到的氢气和一氧化碳在充足的空气中燃烧。
这两个过程的化学方程式为:
a.C(s)+ O2(g) = CO2(g) △H=E1 ①
b.C(s) + H2O(g) = CO(g)+ H2(g) △H=E2 ②
H2(g)+ 1/2 O2(g) = H2O(g) △H=E3 ③
CO(g)+ 1/2 O2(g) = CO2(g) △H=E4 ④
回答:
(1)与途径a相比途径b有较多的优点,即______
(2)上述四个热化学方程式中哪个反应△H >0?_____________(填序号)
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A. a比b多 B. a比b少 C. a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为_______________
23.(4分)已知下列两个热化学方程式:
H2(g)+ O2(g)===H2O(l) ΔH=-285 kJ/mol
O2(g)===H2O(l) ΔH=-285 kJ/mol
C3H8(g)+5O2(g)==3CO2(g)+4H2O(l) ΔH=-2220.0 kJ/mol
(1)实验测得H2和C3H8的混合气体共3 mol完全燃烧生成液态水时放热2790 kJ,则混合气体中H2和C3H8的体积比为 。
(2)已知:H2O(l)==H2O(g) ΔH=+44.0 kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式: 。
22.对于可逆反应A(g)+2B(g) 2C(g) ΔH﹥0,下列图象中正确的是( )
2C(g) ΔH﹥0,下列图象中正确的是( )
|
|
|
|
 二.填空题(共4小题,共33分)
二.填空题(共4小题,共33分)21.已知 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
1mol分子中的化学键断裂时 需要吸收的能量/KJ |
436 |
a |
369 |
则表中a为( )
A.404 B.260 C.230 D.200
20. 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH进行实验,下列说法不正确的是( )
A.改用60mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同
B.用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH
进行实验比用50mL0.50mol/L盐酸和50mL0.50mol/LNaOH测得的数值准确
C.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
D.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热、减少热量损失
19.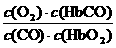 人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2
人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2 O2+HbCO,37
℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37
℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
18.
 下图是表示:2X(g) +Y(g) Z(g)+2R(g) △H<0的化学反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是( )
下图是表示:2X(g) +Y(g) Z(g)+2R(g) △H<0的化学反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是( )
A.减少Z物质 B.升高温度
C.减小压强 D.使用催化剂
17.下列事实中,与电化学腐蚀无关的是( )
A.在空气中,光亮的银表面逐渐变暗
B.为保护海轮的船壳,常在船壳上镶入锌块
C.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
D.镀银的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
16. 在一定的条件下,将 2mol SO2和1mol
O2充入一定容密闭容器中,发生下列反应:2SO2(g)+O2(g)
2SO3(g)△H=-197
kJ/mol, 当达到平衡状态时,下列说法中正确的是( )
在一定的条件下,将 2mol SO2和1mol
O2充入一定容密闭容器中,发生下列反应:2SO2(g)+O2(g)
2SO3(g)△H=-197
kJ/mol, 当达到平衡状态时,下列说法中正确的是( )
A.生成 2 mol SO3 B.放出热量197 kJ
C.SO2 和 SO3 共有 2 mol D.含有氧原子共有3mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com