
题目列表(包括答案和解析)
23.(共15分)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)V2O5是接触法制硫酸的催化剂.
①一定条件下, 与空气反映t min后,
与空气反映t min后, 和
和 物质的量浓度分别为a mol/L和b mol/L, 则
物质的量浓度分别为a mol/L和b mol/L, 则 起始物质的量浓度为 mol/L ;生成
起始物质的量浓度为 mol/L ;生成 的化学反应速率为 mol/(L·min) .
的化学反应速率为 mol/(L·min) .
②工业制硫酸,尾气 用__
__吸收. A、氨水 B、水 C、品红溶液
用__
__吸收. A、氨水 B、水 C、品红溶液
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示.
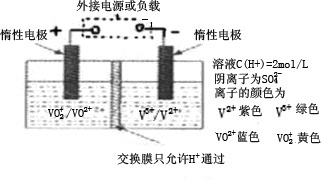
①充电过程中,右槽溶液颜色逐渐由 色变为 色.
②当左槽溶液逐渐由黄变蓝,其电极反应式为 .
③放电过程中氢离子的作用是 和
;充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)的变化量为 .
1023个,左槽溶液中n(H+)的变化量为 .
3. 金属不能从硫酸铜溶液中置换铜。
2. 金属可能是最强的还原剂;
1.金属D与Cu之间电子流动方向为 ;
22. (共3分)如右图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧。在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表)。
(共3分)如右图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧。在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表)。
|
金属 |
电子流动方向 |
电压 |
|
A |
A→Cu |
+0.78 |
|
B |
Cu→B |
-2.15 |
|
C |
C→Cu |
+1.35 |
|
D |
|
+0.30 |
21.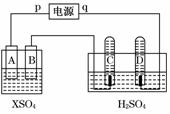 (共11分)如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
(共11分)如图,p、q为直流电源两极,A为+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
(1)p为________极,A极发生了________反应.(填氧化或还原)
(2)C为_______极,试管里收集到的气体是________;D为_______极,试管里收集到的气体是________.
(3)C极的电极方程式是____________________________________________.
(4)在电解过程中,测得的C、D两极上产生的气体的实验数据如下:
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
阴极生成气体体积(cm3) |
6 |
12 |
20 |
29 |
39 |
49 |
59 |
69 |
79 |
89 |
|
阳极生成气体体积(cm3) |
2 |
4 |
7 |
11 |
16 |
21 |
26 |
31 |
36 |
41 |
仔细分析以上实验数据,请说出可能的原因是_________________.
(5)当反应进行一段时间后,A电极附近溶液的pH________(填“增大”“减小”或“不变”).
(6)当电路中通过0.004 mol电子时,B电极上沉积金属X为0.128 g,则此金属的摩尔质量为________.
20.(共9分)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:

 Pb+PbO2+4H++2SO42-
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若人为地用外电源按图连接,电解一段时间后,则在A电极上生成________、B电极上生成________,此时铅蓄电池的正极将变为电解池的________极。
19.(共8分)依据氧化还原反应:2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)设计的原电池如图所示。请回答下列问题:
(1)电极X的材料是_____ ____;电解液Y的溶质是_________;(填化学式)
(2)银电极发生的电极反应为_____________;X电极上发生的电极反应为______________________;
(3)外电路中的电子是从____ ____电极流向_____ ___电极。(填材料名称)
18.(共2分)常温下,pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4︰1的体积比混合,则混合溶液中H+浓度为 (单位:mol·L-1)
17.(共4分)配制氯化铁溶液久置后常出现浑浊现象,其原因是_________________。(用离子方程式解释)
将0.2 mol·L-1的CH3COONa溶液与0.1mol·L-1 HCl等体积混合后,溶液中各种离子的浓度按其从大到小的顺序应为 。(已知等浓度的CH3COOH和CH3COONa混合液偏酸性)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com