
题目列表(包括答案和解析)
7.某无色透明溶液能与Al反应析出H2,则此溶液中可能大量存在的是 ( )
A.OH-、Ba2+、Cl-、AlO2- B.H+、Cl-、AlO2-、Mg2+
C.H+、Mg2+、NO3-、Na+ D.H+、Cu2+、SO42-、K+
6.下列方程式属于水解反应的是 ( )
A.HCO3-+H2O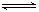 H3O++
H3O++ B.H2O+H2O
B.H2O+H2O 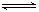 H3O++H+
H3O++H+
C.HCO3- +OH-=H2O+ D.
D. +H2O
+H2O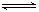
 +OH-
+OH-
5.下列溶液一定呈碱性的是 ( )
A.c(H+)=1×10-7mol/L B.c(OH-)>c(H+)
C.使甲基橙变黄 D.含OH-
4.下列实验中,有白色沉淀产生且不再变化的是( )
A.把CO2通入澄清石灰水中至过量
B.把NaOH溶液逐滴滴加到Al2(SO4)3溶液中至过量
C.向AlCl3溶液中不断滴入氨水至过量
D.把CO2通入CaCl2溶液中
3.某些化学试剂可用于净水。水处理中使用的一种无机高分子凝聚剂的化学式可表示为[Al2(OH)nClm·yH2O]x,式中m等于( )
A.3-n B.6-n
C.6+n D.3+n
2.下列各项性质的递变规律错误的是 ( )
A.稳定性:NH3<PH3<AsH3 B.非金属性:N>P>As
C.还原性:AsH3>PH3>NH3 D.酸性:HNO3>H3PO4>H3AsO4
1. 红磷和白磷在一定条件下可能互变,这一变化属于: ( )
A.物理变化 B.置换反应
C.氧化还原反应 D.非氧化还原反应
24、 (8分)已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(8分)已知水在25℃和95℃时,其电离平衡曲线如右图所示:
(1)25 时水的电离平衡曲线应为哪一条?
(2)25时,将=9的NaOH溶液与=4的
溶液混合,若所得混合溶液的 =7,则
NaOH溶液与溶液的体积比为为多少?
(3)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是?
23、(12分)氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程
示意图如下所示,完成下列填空:

(1)在电解过程中,与电源正极相连的电极上电极反应为____________
______________,与电源负极相连的电极附近,溶液pH_________
(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
____________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试
剂可以是_________。
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_________
(选填a、b、c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加Na2CO3,后加NaOH,再加钡试剂
22、(4分)(1)实事证明,能设计成原电池的反应通常是放热反应,
下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,
其负极反应为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com