
题目列表(包括答案和解析)
28.(1)Cu+H2SO4(浓) =CuSO4+SO2↑+H2O
略
32.计算题(4分)将等体积的4×10-3mol/L的AgNO3溶液和4×10-3mol/L的K2CrO4溶液混合,是否析出Ag2CrO4沉淀?[已知Ksp(Ag2CrO4)=9.0*10-12]
以下为草稿
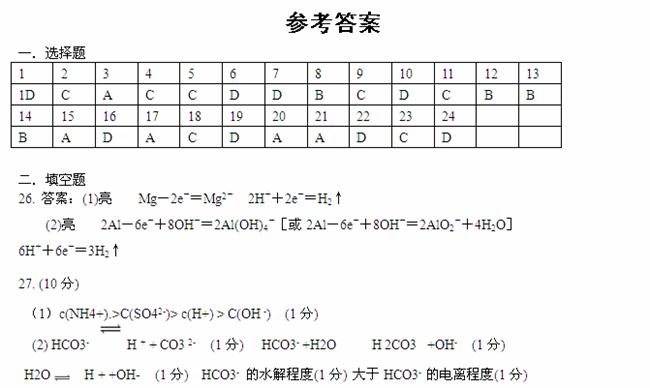 溶液中c(OH-)
> c(H +) (1分) 故溶液显碱性 (1分)
溶液中c(OH-)
> c(H +) (1分) 故溶液显碱性 (1分)
(3)② (1分) ① (1分)
31.(9分)用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:(1)准确称取4.1g烧碱样品,所用主要仪器是 。
(2)将样品配成250mL待测液,需要的仪器有 。
(3)取10mL待测液,用 量取。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时 手旋转 式
滴定管的玻璃活塞, 手不停地摇动锥形瓶,两眼注视 ,
直到滴定终点。
(5)根据下表数据,计算待测烧碱溶液的浓度: 。
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL)[来 |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
(6)根据上述各数据,计算烧碱的纯度: 。
30.(11分)(1)在25℃条件下将pH=10的氨水稀释100倍后溶液的pH为(填序号)__ __。
A.8 B.10 C.10-12之间 D.8-10之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减
小,最主要原因是(填序号)__ ___。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失)。
①__ _和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
(4)已知某溶液中只存在NH4+、Cl-、 H+、OH=四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系:c(NH4+) c(Cl-)。
29.(6分) 在T℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
|
序号 |
氢氧化钡溶液的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
(1)依据题意判断,T℃ 25℃(填“大于”、“小于”或“等于”),该温度下水的离子积KW= 。
(2)x= ,原Ba(OH)2稀溶液的物质的浓度为 。
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2稀溶液时,沉淀正好达到最大值,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为 ,Na2SO4的物质的量浓度为 。
28.(6分)一瓶溶液可能含有OH-、Cl-、CO32-、NO3-和SO42-离子中的一种或几种,取少许溶液分装于三支试管中,进行如下实验操作:
①第一支试管里滴加酚酞试液,溶液变红;加热浓缩、冷却。加足量浓H2SO4和铜片后加热,产生红棕色气体。
②第二支试管里逐滴加入稀硝酸,放出无色气体,该气体能使澄清石灰水变浑浊;继续加稀硝酸到溶液显酸性;加入硝酸钡或AgNO3溶液都不生成沉淀。
③第三支试管中加入Ba(NO3)2溶液,生成白色沉淀。
(1)写出上述三支试管中所发生反应的离子反应式。
①_________________________________________________________;
②_______________________________________________________
_ ;
③________________________________________________________。
(2)该试剂中肯定存在的阴离子是_____________,肯定不存在的离子是_______________。
27.(8分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)0.1mol/L 的( NH4)2SO4 溶液中各种离子浓度大小顺序为:
..
(2)0.1mol/L NaHCO3 溶液中存在的平衡有(用离子方程式表示):
实验测得NaHCO3 溶液的PH>7,请分析NaHCO3 溶液显碱性的原因(用语言描述).
.
(3)将足量的BaCO3分别加入: ① 30 mL H2O ② 50 mL 0.01mol/L氯化钡溶液
③ 100 mL 0.01 mol/L 盐酸中溶解。请确定以上溶液中Ba2+ 的浓度最大的
是 最小的是 (填写序号)
26. (8分)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
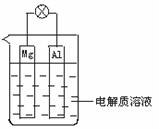
(1)电解质溶液为稀H2SO4时,灯泡_______(填“亮”或“不亮”).若灯泡亮,则Mg电极上发生的反应为:_______________;Al电极上发生的反应为:_______________.若灯泡不亮,其理由为:_________________________________.
(2)电解质溶液为NaOH(aq)时,灯泡__________(填“亮”或“不亮”).若灯泡亮,则Mg电极上发生的反应为:_______________;Al电极上发生的反应为:_______________.
若灯泡不亮,其理由为:________________________.
24. 某溶液中含有NH4+ 、 Mg2+ 、 Al3+、 、 Fe2+ 等四种阳离子,向其中加入过量的
Na2O2 微热并搅拌,再加入过量的HCl溶液,则溶液中大量减少的阳离子是( )
A. NH4+ 、Al3+、 B. NH4+ 、 Mg2+
C. Al3+、 、 Fe2+ D. NH4+ 、Fe2+
23. 下列离子方程式书写正确的是 ( )
A.Na2S溶液的水解:S2-+ 2H2O H2S
+ 2OH-
H2S
+ 2OH-
B.NaHCO3溶液的电离:HCO3-+ H2O H2 CO3+ OH-
H2 CO3+ OH-
C.NH4Cl溶液的水解:NH4+ + H2O NH3·H2O + H+
NH3·H2O + H+
D.把金属铁放入稀硫酸中:2 Fe + 6H+ = 2Fe3+ + 3 H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com