
题目列表(包括答案和解析)
18、(1)已知1 gC2H2气体完全燃烧生成CO2气体和液态水,放出50.0kJ的热量。试写出表示其燃烧热的热化学方程式: 。
 (2)水的电离平衡曲线图如图所示:①若以A点表示25℃时水的电离平衡时的离子浓度;当温度上升至100℃时,水的电离平衡状
(2)水的电离平衡曲线图如图所示:①若以A点表示25℃时水的电离平衡时的离子浓度;当温度上升至100℃时,水的电离平衡状
态到B点,则此时水的离子积从 增加
到 。
②将pH=8的Ba(OH)2溶液与pH=5的
稀盐酸混合,并保持在100℃的恒温,若使混
合液的pH=7,则盐酸和Ba(OH)2溶液的体积
比为 。
17、(1)估计下列变化过程是熵增还是熵减
①NH4NO3爆炸:2NH4NO3(s)==2N2(g)+4H2O(g)+O2(g)
②水煤气转化:CO(g)+H2O(g) ==CO2(g)+H2(g)
③臭氧的生成:3O2==2O3
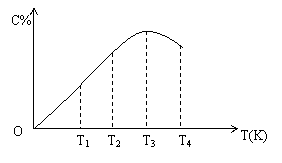 (2)可逆反应A(g)+B(g)
(2)可逆反应A(g)+B(g) 2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度关系如图所示:
2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度关系如图所示:
①由T1向T2变化时,正反应速率 逆反应速率。(填“>”、“<”、“=”)
②由T3向T4变化时,正反应速率 逆反应速率。(填“>”、“<”、“=”)
③反应在 温度下达到平衡。
④此反应的正反应为 反应。(填“吸热”或“放热”)
16、常温下,某强酸pH=a,强碱pH=b,a+b=12,酸与碱混合后pH=7,则V(酸)与V(碱)的关系正确的是( )
A.V(碱) = 102 V(酸) B.V(酸)=102 V(碱) C.V(酸)= 2V(碱) D.V(碱)= 2V(酸)
15、用标准盐酸滴定未知浓度的NaOH溶液时,
若测得结果偏高,则产生误差的原因可能是( )
A.滴定时,装未知浓度的NaOH溶液锥形瓶
忘了用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,忘记用盐酸润洗
C.滴定前,滴定管尖嘴处无气泡,而在滴定后有气泡
D.滴定前仰视读取了酸式滴定管读数,滴定后平视读数。
14、在一密闭容器中进行以下可逆反应:
M(g)+N(g)  P(g)+2L
P(g)+2L
在不同条件下P的百分含量P%的变化情况如下图,则该反应( )
 A.正反应放热,L是固体
A.正反应放热,L是固体
B.正反应放热,L是气体
C.正反应吸热,L是气体
D.正反应放热,L是固体或气体
13、 某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )
提示:BaSO4(s)  Ba2+(aq)+SO42-(aq)的平衡常
Ba2+(aq)+SO42-(aq)的平衡常
数Ksp=c (Ba2+)·c(SO42-),称为溶度积常数
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp小于c点对应的Ksp
12、已知某溶液中存在OH-、H+、NH4+、Cl-4种离子,经4位同学测定其浓度大小关系如下,其中不可能正确的是( )
A.C(Cl-) >C(NH4+) >C(H+) >C(OH-) B.C(NH4+) >C(Cl-) >C(OH-) >C(H+)
C.C(Cl-) >C(NH4+) >C(OH-) >C(H+) D.C(Cl-) >C(H+) >C(NH4+) >C(OH-)
11、为了配制NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量NH4NO3;②适量HCl;③适量氨水;④适量NaOH ( )
A.①② B.②③ C. ①③ D.②④
10、将相同物质的量浓度的某弱酸 HX 与 NaX 溶液等体积混合,测得混合溶液中C(Na+) >C(X-),则下列关系错误的是( )
A.C(HX)>C(X-) B.C(HX)+C(X-)=2 C(Na+)
C.C(HX)+C(H+)= C(Na+) +C(OH-) D.C(OH-)<C(H+)
9、蒸发下列物质的溶液并灼烧,能得到原物质的是( )
A.Fe(NO3)3 B.CuBr2 C.Na2CO3 D.(NH4)2CO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com