
题目列表(包括答案和解析)
21. (13分)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料。已知CuSO4·5H2O的部分结构可表示如下:
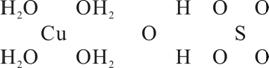
(1)写出铜原子价电子层的电子排布式____________,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有__________(填元素符号)。
(2)请在上图中把CuSO4·5H2O结构中的化学键用短线“--”表示出来。
(3)往浓CuSO4溶液中加入过量较浓的NH3·H2O直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液。小心加入约和溶液等体积的C2H5OH并使之分成两层,静置。经过一段时间后可观察到在两层“交界处”下部析出深蓝色Cu(NH3)4SO4·H2O晶体。实验中所加C2H5OH的作用是______________________________________________。
(4)Cu(NH3)4SO4·H2O晶体中呈正四面体的原子团是______________。
(5)把CoCl2溶解于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl。请写出表示此配合物结构的化学式(钴的配位数为6)___________。
20.(8分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为_____ _____;
(2)写出与H2O分子互为等电子体的微粒__ ________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_ ____
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
19.(6分)第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素。
 (1)已知气态氯化铝的化学式为Al2Cl6,写出Al2Cl6的结构式____________________;
(1)已知气态氯化铝的化学式为Al2Cl6,写出Al2Cl6的结构式____________________;
(2)硼酸的结构式可表示为 ,但硼酸溶于水后,1个硼酸分子与水作用,
只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式: .
18.(13分)现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
|
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
|
D原子核外所有p轨道全满或半满 |
|
E元素的主族序数与周期数的差为4 |
|
F是前四周期中电负性最小的元素 |
(1)BA4E 的水溶液呈_________性(填“酸”或“碱”),用离子方程式解释原因_________.
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形.
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,

该同学所画的电子排布图违背了
(4)DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(5)检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是 .
17.(12分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出A的最高价氧化物与B的最高价氧化物的水化物反应的离子方程式 _______.
(2)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),D的氢化物比C的氢化物的稳定性__________(填"强"或"弱")。
(3)E元素在周期表的第_______周期________族,已知元素周期表可按电子排布分为s区、p区、d区、ds区、f区等,则E元素在_______区。
(4)用电子式表示B的硫化物的形成过程:_________________________________
16. 铅蓄电池(总反应:Pb+PbO2+4H++2SO
铅蓄电池(总反应:Pb+PbO2+4H++2SO = 2PbSO4+2H2O)电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中错误的是 (
)
= 2PbSO4+2H2O)电解苦卤水(含C1一、Br一、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中错误的是 (
)
A.铅蓄电池放电时的正极反应是:
PbO2+4H++SO =PbSO4+2H2O
=PbSO4+2H2O
B.电解苦卤水时,a电极首先放电的是Br一而不是Cl一,说明当其它条件相同时Br一的还原性强于Cl-
C.铅蓄电池充电时,A极应与外接电源负极相连
D.忽略能量损耗,当b极产生0.02g气体时,铅蓄电池中消耗0.02 mol H2SO4
第Ⅱ卷(非选择题 共6小题,共66分)
15.
在2NO2 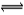 N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
A. N2O4和NO2的分子数比为1:2
B. N2O4和NO2的浓度相等
C.平衡体系的颜色一定不再改变
D.单位时间有1 mol N2O4变为NO2的同时,有1molNO2变为N2O4
14. 已知 蒸发1mol
Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
蒸发1mol
Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HBr(g) |
|
1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为( )
A.200 B.260 C.230 D.404
13.下列化合物中含有2个手性碳原子的是 ( )

12.有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com