
题目列表(包括答案和解析)
4.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
 D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
3.下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
2.在原电池和电解池的电极上所发生的反应,属于氧化反应的是
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
1.下列产品的使用不会对环境造成污染的是
A.含磷洗衣粉 B.氢气 C.一次电池 D.煤
21.(8分)在标准状况下,取甲、乙、丙、丁各100 mL相同浓度的盐酸,然后分别慢慢加入组成相同的镁、铝合金粉末,得到的气体体积与合金的质量有关数据如下表(设产生气体全部逸出):
|
实验序号 |
甲 |
乙 |
丙 |
|
盐酸体积/mL |
100 |
100 |
100 |
|
合金质量/g |
2.55 |
3.85 |
4.59 |
|
气体体积/L |
2.80 |
3.36 |
3.36 |
请回答:
(1)反应产生的气体是 ;在甲组实验中,盐酸 (选填“适量”、“过量”或“不足量”,下同);乙组实验中盐酸 。
(2)盐酸的物质的量浓度为多少?
2010至2011学年度上学期12月份月考高二年级化学科试题
20.(4分)将45mL 0.1mol/L HCl和5mL 0.5mol/L的Ba(OH)2溶液相混合并稀释至500mL,计算所得溶液的pH值。
19.(16分)某学生有0.1000 mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作如下:
(A)用标准溶液润洗滴定管2~3次
(B)取标准KOH溶液注入碱式滴定管至0刻度以上2~3cm
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)调节液面至0或0刻度以下,记下读数
(E)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)上述(A)操作的目的是___________________________________。
(2)用_________滴定管盛装0.1000 mol/L KOH标准液(填“酸式”或“碱式”)。
(3)实验中用________控制滴定管活塞,眼睛注视____________________________,直至滴定终点。判断到达终点的现象是:锥形瓶中溶液的颜色由无色变浅红且保持______秒内不褪色。
(4)上述(E)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是____________(填“偏大”,“偏小”或“不变”,下同)。
(5)若称取含少量NaOH的一定量的KOH固体配制标准溶液并有来滴定上述盐酸,则对测定结果的影响是_____________。
(6)其他操作正确的情况下,滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是____________。
18.(8分)(1)从100mL 0.05mol/L 的H2SO4中取出1mL,其PH值为______; 如果取其0.1mL稀释至1000L溶液的pH值为______。
(2)pH=2的盐酸和醋酸,前者稀释n倍,后者稀释m倍,稀释后,两种溶液的pH值相同,则稀释倍数的关系m______n(填“大于”,“小于”或“等于”)。
(3)下列四种溶液:①pH=0的盐酸 ②0.1mol/L的盐酸 ③0.01mol/L的NaOH溶液 ④pH=11的NaOH溶液,由水电离生成的氢离子浓度之比是 。
17.(12分)0.1mol/L的NaHSO3溶液中存在以下平衡:
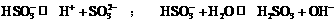
(1)①已知电离>水解,则溶液中c(H+) c(OH-)(填“>”、“=” 或“<” )。
②现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是 ,反应的离子方程式为: 。
(2)氯化铁水溶液呈 性 ,原因是(用离子方程式表示):
_________________________________________________。
在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
16.(12分)将冰醋酸溶于水中,其电离方程式为:_________________________________________。
(1)向0.1mol/L的醋酸溶液中加入等体积水,电离平衡__________移动(填“向右”,“向左”或“不”),c(H+)将___________(填“增大”,“减小”或“无法确定”)。
(2)向同浓度的醋酸溶液中加入少量醋酸钠固体(设加入固体前后,溶液体积不变),待固体溶解后,电离平衡____________移动(填“向右”,“向左”或“不”),c(H+) / c(CH3COOH)的比值将__________(填“增大”,“减小”或“无法确定”),请写出醋酸钠水解的离子方程式:______________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com