
题目列表(包括答案和解析)
10.现有甲、乙、丙、丁四种金属,为了判断其活泼性强弱,某同学设计了下列实验:
①甲、乙在氢氧化钠溶液中构成原电池,根据气泡产生的电极,确定甲、乙活泼性
②将等物质的量的丙、丁放入稀硫酸中,比较产生氢气的量,从而比较丙、丁活泼性
③以石墨为电极,电解等物质的量浓度的乙、丁的硫酸盐溶液,根据阴极先析出的金属判断乙、丁活泼性
④将甲单质投入丙的盐溶液中,根据是否置换出丙单质判断甲、丙的活泼性
上述实验能达到实验目的的是( )
A.①④ B.②③ C.③ D.③④
9.100 mL 0.1 mol / L的盐酸与50 mL 0.2 mol / L的氨水混合,充分反应后,所得溶液中各种粒子浓度关系正确的是( )
A.c(H+)+c(NH4+) =c(Cl-) + c(OH-) B.c(Cl-) = c(NH4+) >c(OH-) = c(H+)
C.c(Cl-) >c(NH4+) > c(OH-) >c(H+)
D.c(H+) + c(Cl-) =c(NH4+) + c(NH3·H2O) + c(OH-)
8.下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF溶液与NaCl溶液不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
A.①②③ B. ①②④ C. ①②③④ D.①④
7.下列溶液中微粒的物质的量浓度关系正确的是( )
A.25℃时,0.1mol/L的 pH=4.5的NaHC2O4溶液:c(HC2O4-) >c(H2C2O4)>c(C2O42-)
B.25℃时,pH=9、浓度均为0.1 mol/L的NH3·H2O和NH4Cl混合溶液:
c(NH4+)+c(H+)>c(NH3·H2O)+c(OH-)
C.NaHCO3溶液:c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
D.0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
6.在给定条件的水溶液中一定能大量共存的离子组是( )
A.能与Al反应生成H2的溶液:Ca2+、NH4+、HCO3-、Cl-
B.c(Fe2+)=0.05mol/L的溶液:H+、Na+、NO3-、SO42-
C.常温下,pH=12的溶液:Na+、K+、Cl-、NO3-
D.由水电离出的c(H+)=10-12mol/L的溶液:K+、Ba2+、ClO-、NO3-
5.用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的是( )
A.用蒸馏水洗净滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液
C.用酚酞作指示剂时,滴至溶液从红色变成无色即视为滴定终点
D.用碱式滴定管取10.00mLNaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
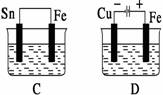
4.下图水槽中盛装的是海水,其中铁被腐蚀最慢的是( )

3.用石墨作电极,电解1mol·L-1下列物质的水溶液,溶液的pH保持不变的是( )
A.NaOH B.HCl
C.KCl D.Na2SO4
2.化学平衡主要研究下列哪一类反应的规律( )
A.离子反应 B.化合反应
C.可逆反应 D.气体反应
1.设C(s)+CO2(g)
 2CO(g) △H1>0 反应速率为v1;设N2(g)
+ 3H2(g)
2CO(g) △H1>0 反应速率为v1;设N2(g)
+ 3H2(g)  2NH3(g) △H2<0 反应速率为v2.对于上述反应,当温度降低时,v1和v2的变化情况为(
)
2NH3(g) △H2<0 反应速率为v2.对于上述反应,当温度降低时,v1和v2的变化情况为(
)
A.都增大 B.都减小 C.v1增大,v2减小 D.v1减小,v2增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com