
题目列表(包括答案和解析)
25.(12分)某研究性小组进行如下实验:常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混
合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
|
① |
0.1 |
0.1 |
pH=9 |
|
② |
c |
0.2 |
pH=7 |
|
③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?__________(填“强酸”或“弱酸”)。
(2)②组情况表明,c____ 0.2 mol/L(填﹥、﹤或=)。混合液中离子浓度c(A-) c(Na+)(填﹥、﹤或=)。
(3)从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (填﹥、﹤或=),该混合溶液中离子浓
度由大到小的顺序是_____ ___。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。
24.(8分)⑴向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子恰好沉淀完全时,溶液PH 7 (填﹥、﹤
或=),离子反应总方程式为 。
(2)向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子恰好沉淀完全时,溶液PH 7 (填﹥、﹤或=),
离子反应总方程式为 。
23. (6分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:____ ______________。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3·xH2O),反应的化学方程式为_____________ ___ _________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被完全除尽后,溶液中继续发生的化合反应
的化学方程式为____________________________。
22.(10分)常温下,将0.02molNaOH和0.1molNH4Cl溶于水配成1L溶液,
(1)(6分)该溶液中存在的三个平衡体系为_______ __ 、_ _、 _____ _ _ ___。
(2)(2分)溶液中共有 种不同的粒子。
(3)(2分)物质的量之和为0.1mol的两种粒子是___ __、 。
21.(4分)某原电池总反应离子方程式为.2Fe3++Fe=3Fe2+ ,不能实现该反应的原电池是
①正极为Cu,负极为Fe,电解质溶液为FeCl3 溶液
②正极为C,负极为Fe,电解质溶液为Fe(NO3)3 溶液
③正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 溶液
④正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
20、
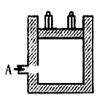 右图为一恒压容器。恒温下,将
右图为一恒压容器。恒温下,将 和
和 混合后由
混合后由 口快速充入容器,封闭
口快速充入容器,封闭 ,反应N2(g)+3H2(g) 2NH3(g)在
,反应N2(g)+3H2(g) 2NH3(g)在 时刻达到平衡,
时刻达到平衡, 时刻再从
时刻再从 口快速充入一定量
口快速充入一定量 ,封闭
,封闭 ,
, 时刻重新达平衡至
时刻重新达平衡至 时刻。在
时刻。在 时间内混合气体中
时间内混合气体中 的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是( )
的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是( )

第Ⅱ卷(非选择题,共50分)
19.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是( )
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;②在配制烧碱溶液时,将
称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线;③中和滴定
时,锥形瓶内有少量水;④酸式滴定管用蒸馏水洗后,未用标准液润洗;⑤读取滴定管终点读数时,仰视刻度线。
A.①②③ B.③④⑤ C.②④⑤ D.①②③④⑤
18.已知mX(g)+nY(g)
 gZ(g) ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是 ( )
gZ(g) ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是 ( )
A.升高温度,平衡将正向移动 B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小 D.增加X的物质的量,Y的转化率降低
17.下列事实不能用勒夏特列原理解释的是 ( )
A.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
B.开启啤酒瓶后,瓶中立刻泛起大量泡沫
C.向氯水中加CaCO3后,溶液漂白性增强
D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
16.为了得到比较纯净的物质,使用的方法恰当的是( )
A.向Na2CO3饱和溶液中,通入过量的CO2后,在加热的条件下,蒸发得NaHCO3晶体
B.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com