
题目列表(包括答案和解析)
6.对于相同温度时三种溶液:a.盐酸 b.醋酸 c.氯化铵溶液。下列说法正确的是
A.相同浓度的三种溶液,溶液中的c(H+)相同
B.相同浓度的三种溶液中水的电离程度:c>b>a
C.pH相同的三种溶液完全反应消耗的氢氧化钠的物质的量:a > c > b
D.同浓度、同体积三种溶液与一定量NaOH恰好反应后,阴离子浓度相同
5.相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
|
容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
|
X2 |
Y2 |
XY3 |
||
|
① |
1 |
3 |
0 |
放热 23.15 kJ |
|
② |
0.6 |
1.8 |
0.8 |
放热为Q kJ |
下列叙述正确的是
A.容器①、②中反应的平衡常数不相等
B.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C.容器②中反应达到平衡时放出的热量为Q 也为23.15KJ
D.若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ
4.下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)
B.已知25°C时 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到 mol·L-1
mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
3.某溶液中含有K+、Mg2+、Al3+、Cu2+等离子,为了将它们一一分离(不要求各离子恢复到原来的形态),某同学设计了如下四个实验方案,其中不正确的是[已知:Mg2+、Al3+溶液中通入H2S不产生沉淀;Ksp(CuS )=1.3×10-36。]

|
|
|
|

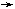
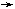
|
|
|
|

|
|
|

|
|

|
|
|
|

|
|
|

|
|
|

|
|




2.下列溶液中有关微粒浓度的关系不正确的是
A.向0.2 mol/L KA溶液中加入等体积的0.1 mol/L HCl溶液,得pH=10的混合溶液:
c(K+)>c(HA)>c(Cl-)>c(A-)
B.c1 mol/L pH=a的醋酸,c2 mol/L pH=b的醋酸,若a+1=b,则c1 >10 c2
C.浓度均为0.1 mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
D.某二元弱酸的酸式盐NaHA溶液:c(H+)+c(H2A)=c(OH-)+c(A2-)
1.某温度下,pH相同的硫酸溶液和硫酸铝溶液中由水电离出的c(H+)分别是1.0×10-10mol/L和1.0×10-3mol/L,则此温度下水的离子积KW为
A.1.0×10-15 B.1.0×10-14 C.1.0×10-13 D.1.0×10-7
15. 元素的种类和原子的种类
A.前者大 B.后者大 C.相同 D.无法确定
14.“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是
A.构造原理 B.泡利原理 C.洪特规则 D.能量最低原理
13.下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O B.BF3 C.CCl4 D. PCl5
12.下列各物质中所有原子都满足最外层8电子结构的是
①N2 ②Cl2 ③CO2 ④PCl3 ⑤ H2O ⑥ PCl5 ⑦ CCl4
A. 全部 B.①②③⑥ C.②④⑦ D.①②③④⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com