
题目列表(包括答案和解析)
29、
|
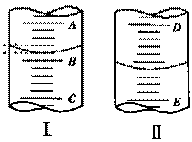
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是________mL。
(2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL B.是(50-a)mL
C. 一定大于amL D.一定大于(50-a)mL |
 |
(3)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
28.现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已经略去):

请回答:
(1)A、W的溶液分别加热蒸干并灼烧最后所得固体为 、 (填化学式)。
(2)在D溶液中滴入酚酞,所观察到的现象是 ,若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是 ,其原因是(以离子方程式和简要文字说明): 。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是
。(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是
27. 830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
试回答下列问题:
(1)若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
(2)在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态
(填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”).
(3)若降低温度,该反应的K值将 ,该反应的化学反应速率将
(均填“增大”“减小”或“不变”)。
26、 A、B代表不同物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________,A2________,B1________,B2________;
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为_______________;
(3)写出0.1 mol/L的B2溶液中离子浓度大小排序_________________________;
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_______________
___________________________________________________________________;
(5)若B1、B2两溶液的pH=5,则常温下两溶液中水电离出的氢离子的物质的量浓度之比为__________________。
25.中学阶段介绍的应用电解法制备的物质主要有三种:一是铝的工业制备;二是电解饱和NaCl溶液制备烧碱;三是金属钠的制备。下列关于这三个工业生产的描述中正确的是( )
A.电解法制铝时一般是用熔融态的氧化铝进行电解,但也可用其相应的盐如熔融态的A1C13
B.电解法生产铝时,每转移3mol电子的时候,就能生产出1mol的铝。
C.在电解饱和NaCl溶液中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.电解饱和NaCl溶液和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是C1-失电子
|
24.物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3
⑤NH4HCO3,按c(CO32-)由小到大排列顺序正确的是( )
A、⑤<④<③<②<① B、③<⑤<②<④<①
C、③<②<⑤<④<① D、③<⑤<④<②<①
23.下图有关电化学的示意图正确的是( )
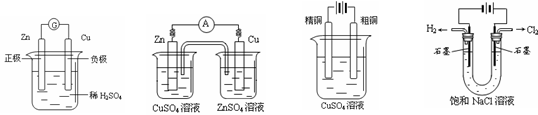

A. B. C. D
22. COCl2(g)  CO(g)+Cl2(g);
CO(g)+Cl2(g);
 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
21.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排序正确的是( )
A.c(OH)>c(HA)>c(HB)>c(H+) B. c(OH-)>c(A-)>c(B-)>c(H+)
C. c(OH-)>c(B-)>c(A-)>c(H+) D. c(OH-)>c(HB)>c(HA)>c(H+)
20.下列说法不正确的是( )
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应 不能自发进行,则该反应的
不能自发进行,则该反应的
C.一定条件下,使用催化剂能加快反应速率,但不能提高反应物的平衡转化率
D.相同条件下,溶液中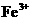 、
、 、
、 的氧化性依次减弱
的氧化性依次减弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com