
题目列表(包括答案和解析)
14. 反应2X(g)+Y(g)  2Z(g) △H,在不同温度(T1和T2)及压强(P1和P2)下,产物Z 的物质的量n(Z)与反应时间t的关系如图所示,下述判断正确的是( )
2Z(g) △H,在不同温度(T1和T2)及压强(P1和P2)下,产物Z 的物质的量n(Z)与反应时间t的关系如图所示,下述判断正确的是( )
A.T1<T2,P1<P2 △H<0
B.T1 > T2,P1>P2 △H > 0
C.T1>T2,P1>P2 △H <0
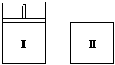 D.T1>T2,P1<P2 △H >0
D.T1>T2,P1<P2 △H >0
13. 把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合,溶液显酸性,则混合溶液中微粒浓度关系正确的是 ( )
A.C(Na+)>C(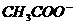 )
)  B.C(CH3COOH)>C(
B.C(CH3COOH)>C(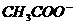 )
)
C.2C(H+)=C(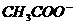 )-C(CH3COOH)+2C(OH-)
)-C(CH3COOH)+2C(OH-)
 D.C(CH3COOH)+ C(
D.C(CH3COOH)+ C(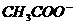 )=0.02mol/L
)=0.02mol/L
12.醋酸溶液中存在电离平衡 CH3COOH H++CH3COO-,下列叙述不正确的是 ( )
H++CH3COO-,下列叙述不正确的是 ( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH与pH=12的NaOH溶液等体积混合,溶液pH<7
11. 在一个固定容积1L的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)≒3C(g)+D(s),达到平衡时C的浓度为1.2mol/L,若维持容器的容积和温度不变,按下列4种配比作为起始物质,达到平衡时C的浓度仍为1.2mol/L的是 ( )
A. 4molA+2molB B.1molA+0.5molB+1.5molC
 C.
3molC+1molD+1molB
D.1.4molA+0.7molB+0.9molC
C.
3molC+1molD+1molB
D.1.4molA+0.7molB+0.9molC
10.某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
A. 它是副族元素 B. 它是第六周期元素
C. 它的原子核内有63个质子 D. 它的一种同位素的核内有89个中子
9. (1)Zn(s)+1/2O2(g)==ZnO(s);ΔH=-348.3kJ/mol
(2)2Ag(s)+1/2 O2(g)== Ag2O(s);ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol
8. 对于可逆反应4
NH3(g)+5O2(g) 4NO(g)+6
H2O(g)下列叙述正确的是( )
4NO(g)+6
H2O(g)下列叙述正确的是( )
A.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
 D.化学反应速率关系是:2υ正(NH3)=
3υ正(H2O)
D.化学反应速率关系是:2υ正(NH3)=
3υ正(H2O)
7. 用0.1 mol•. 的盐酸滴定0.10 mol•.
的盐酸滴定0.10 mol•. 的氨水,滴定过程中不可能出现的结果是
的氨水,滴定过程中不可能出现的结果是
A. >
> ,
, >
> B.
B.  =
= ,
, =
=
C. >
> ,
, >
> D.
D.  >
> ,
, >
>
6. 在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g) 2Z(g),并达平衡,以Y的浓度改变表示的反应速度V正、V逆与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)( )
2Z(g),并达平衡,以Y的浓度改变表示的反应速度V正、V逆与时间t的关系如图所示,则Y的平衡浓度表达式正确的是(式中S是对应区域的面积)( )
 A.2-Saob B.1-Saob C.2-Sabdo D.1-Sbod
A.2-Saob B.1-Saob C.2-Sabdo D.1-Sbod
5.根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
 A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
 C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com