
题目列表(包括答案和解析)
23. ⑴平衡,0.05mol·L-1·min-1,0.975mol·L-1;⑵不,向正反应方向
22. 大于(2分) 水的电离反应:H2O H++OH-是吸热反应,升温有利于水的电离,使KW增大(2分)
H++OH-是吸热反应,升温有利于水的电离,使KW增大(2分)
(1)10∶1(2分)
(2)9∶2(2分)
(3) 27.(2分)某学校化学课外小组用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。 ①应选择 作指示剂。 ②为减小滴定误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是 (填选项字母) A.1mol/L 50mL B.0.20mol/L 25mL C.0.02mol/L 5mL D.5mol/L 10mL 28.(6分)已知25℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因而pH增大。你认为上述解释中 (“甲”或“乙”)正确。 (1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量的下列物质中的 (填写编号),然后测定溶液的pH。 A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3 (2)若 (填“甲”或“乙”)的解释正确,溶液的pH应 (填“增大”“减少”或“不变”)。 六、计算题(本题包括1小题,共10分)
29.(10分) 将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2+O2
2H2+O2
2CO+O2 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是 和 ,或 和 。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为 n(O2)平=a mol, n(CO2)平=b mol。试求n(H2O)平= 。(用含a、b的代数式表示)
w。w-w*k&s%5¥u
综合测试题二
26. (8分)下列各物质转化关系如图所示,
(8分)下列各物质转化关系如图所示,
A是一种高熔点固体,D是一种红棕色固体。
根据上述一系列关系回答:
(1)填写物质的化学式:A ,B 。
(2)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J___________。
②E和盐酸反应 。
③F生成G 。
24.(4分) 现有反应:CO(g)+ H2O(g)  CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1) 若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2) 850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和 x molH2,则: ①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。 ②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(3) 在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______ b(填“大小”、“小于”或“等于”)。 25.(8分) 已知某溶液中只存在OH一、H+、NH4+、Cl一四种离子,某同学推测其离子浓度大小顺序有如下四种关系: ①(Cl一)>c(NH4+)> c(H+)> c(OH-) ②c(Cl一) >c(NH4+)> c(OH-)> c(H+) ③c(NH4+)>c(Cl一)> c(OH-)> c(H+) ④ c(Cl一) >c(H+)> c(NH4+)> c(OH-) 填写下列空白: (1)由若溶液中只溶解了一种溶质,则该溶质是__________,上述四种离子浓度的大小顺序为_______________(填序号) (2)若上述关系中③是正确的,则溶液中的溶质为____________________; 若上述关系中④是正确的,则溶液中的溶质为________________________。 (3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________c(NH3·H2O)(填“大于”、“小于”或“等于” 下同),混合前酸中c(H+)和碱中c(OH-)的关系:c(H+)____________ c(OH-)。 四、推断题(本题包括1小题,共8分)
23.(5分) 向一容积为5L的密闭容器中充入NH3和O2,它们的物质的量之比为1︰2,发生如下反应: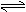 4NH3+O2 4NO+6H2O(g)。
4NH3+O2 4NO+6H2O(g)。
⑴上述反应在一定条件下2min后该反应的△H--T△S== 0,此时该反应达到_______状态,NH3为2mol,NH3的转化率为20%。以NO的浓度变化表示该反应的平均反应速率为__________,O2的平衡浓度为_____________。
⑵在达到平衡后,加入相当于原组成气体1倍的惰性气体。如果容器的体积不变,平衡________移动,如果总压强保持不变,平衡_________移动。
22.(5分)某温度(t℃)时,水的KW=10-13,则该温度(填大于、小于或等于) 25℃,其理由是 。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,
(1)若所得混合液为中性,则a∶b ;
(2)若所得混合液的pH=2,则a∶b ;
21.(2分)298K时,合成氨反应的热化学方程式为 N2(g)+3H2(g)  2NH3(g);△H== -92.4KJ·mol-
2NH3(g);△H== -92.4KJ·mol-
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4KJ。其原因是
20. 室温下0.1mol·L-1NaOH溶液滴定amL某浓度的HCl溶液,达到终点时消耗NaOH溶液bmL,此时溶液中氢离子的浓度[H+]是( ) (mol·L-1)
A 0.1/(a+b) B 0.1b/(a+b) C 1×107 D 1×10-7
19. 在密闭容器中发生反应:aX(气)+bY(气) cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
cZ(气)+dW(气)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是( )
A.平衡向逆反应方向移动 B.a + b > c + d
C. Z的体积分数减小 D.X的转化率下降
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com