
题目列表(包括答案和解析)
1、必须有正确的思路:

3.导出式--质子守恒:
如碳酸钠溶液中由电荷守恒和物料守恒将Na+离子消掉可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。此关系式也可以按下列方法进行分析,由于指定溶液中氢原子的物质的量为定值,所以无论溶液中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也就是说结合的氢离子的量和失去氢离子的量相等。可以用图示分析如下:
 ,由得失氢离子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。
,由得失氢离子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。
又如醋酸钠溶液中由电荷守恒和物料守恒将钠离子消掉可得:c(OH-)=c(H+)+c(CH3COOH)。
[规律总结]
2.物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中n(Na+):n(c)=1:1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
[注意]书写电荷守恒式必须①准确的判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系。
1.电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)推出:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
2.水解理论:
⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+)>c(HCO3-)。
⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;例如(NH4)2SO4溶液中微粒浓度关系。
[分析]因溶液中存在下列关系:(NH4)2SO4=2NH4++SO42-,
+
2H2O 2OH-+2H+,
2OH-+2H+,

2NH3·H2O,由于水电离产生的c(H+)水=c(OH-)水,而水电离产生的一部分OH-与NH4+结合产生NH3·H2O,另一部分OH-仍存在于溶液中,所以溶液中微粒浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)。
⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)>c(OH-),水解呈碱性的溶液中c(OH-)>c(H+);
⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。例如Na2CO3溶液中微粒浓度关系。
[分析]因碳酸钠溶液水解平衡为:CO32-+H2O HCO3-+OH-,H2O+HCO3-
HCO3-+OH-,H2O+HCO3- H2CO3+OH-,所以溶液中部分微粒浓度的关系为:c(CO32-)>c(HCO3-)。
H2CO3+OH-,所以溶液中部分微粒浓度的关系为:c(CO32-)>c(HCO3-)。
1.电离理论:
⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;例如NH3·H2O溶液中微粒浓度大小关系。
[分析]由于在NH3·H2O溶液中存在下列电离平衡:NH3·H2O  NH4++OH-,H2O
NH4++OH-,H2O  H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
⑵多元弱酸的电离是分步的,主要以第一步电离为主;例如H2S溶液中微粒浓度大小关系。
[分析]由于H2S溶液中存在下列平衡:H2S  HS-+H+,HS-
HS-+H+,HS-  S2-+H+,H2O
S2-+H+,H2O  H++OH-,所以溶液中微粒浓度关系为:c(H2S )>c(H+)>c(HS-)>c(OH-)。
H++OH-,所以溶液中微粒浓度关系为:c(H2S )>c(H+)>c(HS-)>c(OH-)。
18.(6分)1体积某烃的蒸气完全燃烧生成的CO2比水蒸气少1体积(相同条件),0.1mol该烃完全燃烧其生成物全部通过浓硫酸吸收,浓硫酸增重16.2g。试解答:
(1)该烃的分子式 ;(H-1 C-12 O-16)
(2)若该烃的一氯代物只有一种,试写出该烃的结构简式并用系统命名法命名。
。
班级 姓名 考号
17.(10分)已知:二烯烃与Br2发生1:1加成时,有以下两种情况:
 CH2 = CHCH = CH2
+ Br2
CH2BrCHBrCH = CH2 (1,2-加成)
CH2 = CHCH = CH2
+ Br2
CH2BrCHBrCH = CH2 (1,2-加成)
 CH2 = CHCH = CH2
+ Br2
CH2BrCH = CHCH2Br (1,4-加成)
CH2 = CHCH = CH2
+ Br2
CH2BrCH = CHCH2Br (1,4-加成)
利用以上信息,按以下步骤从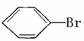 合成
合成 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
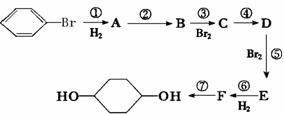
请回答下列问题:
(1)分别写出B、D的结构简式:B_________ D_________
(2)反应①-⑦中属于消去反应的是____ _ (填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到E的其他可能的结构简式:
(4)试写出C →D反应的化学方程式(有机物写结构简式,并注明反应条件)
16.Ⅰ.(8分)为探究溴乙烷与NaOH乙醇溶液发生反应后生成的气体中是否含不饱和烃的装置如右图所示。回答:
(1)A装置中反应的化学方程式为
(2)B装置的作用是 ;
(3)若省去装置B,C装置中试剂应改为 ,反应的化学方程式为
Ⅱ.(10 分)下图为苯和溴取代反应的改进实验装置。其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑。
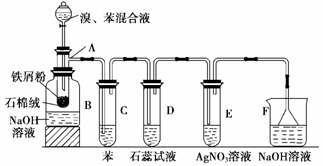
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):___________________________________。
(2)试管C中苯的作用是 ;能说明苯与溴发生的是取代反应而不是加成反应的现象为_______ _____________。
(3)D、E中长导管不插入液面下的原因是 。
(4)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是 。
15.(10分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。
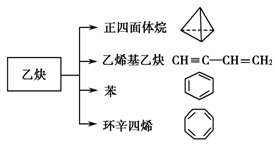
完成下列各题:
(1)正四面体烷的分子式为________,其二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误的是________。
a.能使酸性KMnO4溶液褪色
b.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子发生加聚反应的化学方程式
 _______________________________。
_______________________________。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(任举一例)________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com