
题目列表(包括答案和解析)
1.微粒间相互作用的能量:范德华力为a kJ·mol-1,化学键为b kJ·mol-1,氢键为c kJ·mol-1,则一般情况下a、b、c的大小关系正确的是
A.a>b>c B.b>a>c C.c>b>a D.b>c>a
21、(1) , 。(2) ___ 。
20.(1) ,(2) 。(3)
(4)① 。
② 。
(5) 。
18、(1) __________ ; (2) _______________ ;
(3) _____________ 。 (4) ________________ 。
19(1)K= 。(2) ______ 。
(3) ______ 。(4) 。
17. (1) ______________________, ______________________________________________。
(2) ____________ , (3) __________ ,____________________________________________; _____________, ______________________________________________ 。
21、(9分)已知T℃、p kPa时,往容积可变的密闭容器中充入2 mol X和1 mol Y,此时容积为VL。保持恒温恒压,发生反应:2X(气)+Y(气) 2Z(气),达到平衡时,平衡气中Z的体积分数为0.4。试回答下列有关问题:
2Z(气),达到平衡时,平衡气中Z的体积分数为0.4。试回答下列有关问题:
(1)使温度和压强在上述条件下恒定不变,再往上述密闭容器内充入4molZ,则反应达到平衡时,容器的容积为 ,平衡气中Z的体积分数为 。
(2)若另选一个容积固定不变的密闭容器,仍控制温度为T℃,使3molX和1.5molY反应,达到平衡状态时, 平衡气中Z的体积分数仍为0.4,则该密闭容器的容积为 。
高级中学2010-2011学年第二学期期中测试
第Ⅱ卷答卷纸(本卷共计 共52分)
20.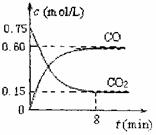 (13分)一定条件下铁可以和CO2发生反应:
(13分)一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并
充入一定量的CO2气体,反应过程中CO2气体和
CO气体的浓度与时间的关系如图所示,求8分钟
内CO的平均反应速率v(CO)= 。
(2)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号)。
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛。
①FeCl3溶液可用于天然气脱硫,写FeCl3溶液与天然气中H2S反应的离子方程式:
。
②高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为 。
(5)已知:2CO(g)+O2(g)==2CO2(g) △H=-566 kJ/mol;2H2(g)+O2(g)==2H2O(g) △H=-483.6 kJ/mol。写出CO和H2O(g)作用生成CO2和H2的热化学方程式
。
19.(8分)在一定体积的密闭容器中进行如下反应:
CO2(g)+H2(g) CO(g)+H2O(g);其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g);其化学平衡常数K和温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(选填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)若向容器中投入各物质2mol,加热到800℃使进行反应,到达平衡时物质的量增加的物质是 。
18、(8分
)在一定条件下,可逆反应:mA+nB pC达到平衡,若:
pC达到平衡,若:
(1) A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的大小关系是 ;
(2) A、C是气体,若增加B的量,平衡不移动,则B应为 态;
(3) A、C是气体,而且m+n = p,增大压强可使平衡发生移动,则平衡移动的方向必是 。
(4) 加热后,可使C的质量增加,则正反应是 反应(选填“放热”或“吸热”)。
17. (14分)中和热是指酸跟碱发生中和反应生成lmol
H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将①50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(14分)中和热是指酸跟碱发生中和反应生成lmol
H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将①50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_________________________________。
(2) 若将盐酸换成同浓度和同体积的醋酸,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中改用40 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上
述实验相比,所放出的热量______ __(填“比①大”、 “比①小”或“相等”),理由是_______________________________________________ ___;所求中和热的数值会________(填“相等”或“不相等”),理由是______________________________________________ ____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com