
题目列表(包括答案和解析)
6、目前,科学界拟合成一种“二重构造”的球型分子,即把“足球型”的C60(富勒烯)溶进“足球型”的Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种分子的说法中不正确的是
A.是一种新型化合物 B.晶体属于分子晶体
C.分子中不含极性键 D.相对分子质量为2400
5、“类推”是常用的学习方法,但有时会产生错误结论。下列类推的结论中,正确的是
A.ⅣA族元素氢化物沸点顺序是GeH4 >SiH4 >CH4;则ⅤA族元素氢化物沸点顺序也是AsH3 >PH3 >NH3
B.第二周期元素氢化物稳定性顺序是HF >H2O >NH3;则第三周期元素氢化物稳定性顺序也是HCl >H2S >PH3
C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,也必有阴离子 D.NH3分子的空间构型是三角锥形;则BF3分子的空间构型也是三角锥形
4、下列有关化学用语正确的是
A.乙烯的最简式:C2H4
B.3,3-二甲基-1-戊烯的键线式: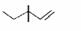
C.乙炔的电子式: 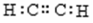 D.乙醛的结构简式:CH3COH
D.乙醛的结构简式:CH3COH
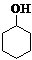
3.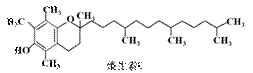 下列物质属于酚类的是
下列物质属于酚类的是
 A.
B.
A.
B.

 C. D.
C. D.
2、下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小: NaF> NaCl> NaBr>NaI
1、3月11日,日本发生的9.0级大地震并发海啸引起福岛核电站危机。 3月28日,日本政府宣布从受到破坏的福岛第一核电站区域内土壤中检测出放射性钚-238(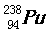 )、钚-239(
)、钚-239(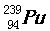 )和钚-240(
)和钚-240(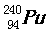 ),“表明了事故的重大性和严重性”。3月30日,在我国沿海和内地的部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素碘-131(
),“表明了事故的重大性和严重性”。3月30日,在我国沿海和内地的部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素碘-131( ),其对公众可能产生的附加辐射剂量小于岩石、土壤、建筑物、食物、太阳等自然辐射源的天然本底辐射剂量的十万分之一,对环境和公众健康不会产生影响,无需采取任何防护措施。下列关于钚元素和碘元素的说法正确的是:
),其对公众可能产生的附加辐射剂量小于岩石、土壤、建筑物、食物、太阳等自然辐射源的天然本底辐射剂量的十万分之一,对环境和公众健康不会产生影响,无需采取任何防护措施。下列关于钚元素和碘元素的说法正确的是:
A.钚-238、钚-239和钚-240是同素异形体的关系
B.钚元素和碘元素在元素周期表中都属于主族元素
C.碘-131原子的核外电子数是53,中子数是88
D.基态碘原子的最外层电子排布式是5s25p5
25. (12分)下图所示装置中,甲、乙、丙三个烧杯
(12分)下图所示装置中,甲、乙、丙三个烧杯
依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4
溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4
溶液质量减少4.5g,乙中c电极质量增加。据此回答
问题:①电源的N端为 极;(2分)
②电极b上发生的电极反应为 ;(2分)
③列式计算电极b上生成的气体在标准状态下的体积: L;(2分)
④电极c的质量变化是 g;
⑤电解前后各溶液的pH值是否发生变化(填增大,减小,不变)
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
,原因
24.(8分,每空2分)工业上制取CuCl2的生产流程如下:

请结合下表数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3-4 |
⑴ 溶液A中加入NaClO的目的是 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的
是 。
23.(14分)传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高。
随着DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)的发明和使用,这一问题有了很大程度的改善。某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。实验步骤如下:
⑴用 (填仪器名称)量取10.00mL氨水样品,在 (填仪器名称)中用一定量蒸馏水稀释并 后转移(含洗涤液)到100mL (填仪器名称)中,用 (填仪器名称)加蒸馏水定容、混匀后,将所得溶液装入试剂瓶备用。
⑵量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果 (填“是”、“否”、“不能确定”),
理由是 。
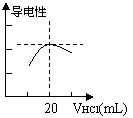 ⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示
⑶向锥形瓶中滴加0.1000mol/L的盐酸,计算机屏幕上显示
出溶液导电能力与加入盐酸体积关系的曲线图(见右)。
①滴定管盛放盐酸前,要先 ,然后用蒸馏水冲洗
2至3次,再用 ,然后才能盛放盐酸。滴定管
中加入盐酸、排净尖嘴部分的气泡后,凹液面的最低点应处于滴定管的 。
②氨水与盐酸反应的离子方程式为 。
③该氨水样品的物质的量浓度为 mol•L-1。
⑷另一学习小组乙认为上述测量结果仍存在一定的误差,因为生成的NH4Cl是强酸弱碱盐,会发生水解而使NH+ 4浓度下降,这样,恰好完全反应时NH+ 4浓度不是最大值,溶液导电性就不会是最大值。
①你认为学习小组乙的结论是否正确? (填“正确”、“不正确”)
②当溶液pH=7时,溶液中各离子浓度大小的关系是 。
22.某电池总反应的离子方程式为:2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
A.正极为铜,负极为铁,电解液为氯化铁溶液
B.正极为石墨,负极为铁,电解液为硝酸铁溶液
C.正极为银,负极为铁,电解液为硫酸铁溶液
D.正极为铁,负极为锌,电解液为硫酸铁溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com