
题目列表(包括答案和解析)
18.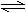
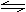
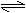 已知H2CO3 H-+HCO3-,K1=4.3×10-7;HCO3- H++CO32-,K2=5.6×10-11;HClO H++ClO-,K=3.0×10-8,根据上述电离常数分析,下列各式中错误的是
已知H2CO3 H-+HCO3-,K1=4.3×10-7;HCO3- H++CO32-,K2=5.6×10-11;HClO H++ClO-,K=3.0×10-8,根据上述电离常数分析,下列各式中错误的是
A.Ca(ClO)2+2HCl=CaCl2+2HClO
B.Ca(ClO)2+2H2O+2CO2=Ca(HCO3)2+2HClO
C.NaClO+CH3COOH=CH3COONa+HClO
D.NaClO+NaHCO3=Na2CO3+HClO
17. 已知某温度下,可逆反应H2(g)+I2(g) 2HI(g)的平衡常数K=25,则可逆反应
已知某温度下,可逆反应H2(g)+I2(g) 2HI(g)的平衡常数K=25,则可逆反应
 HI(g) 1/2H2(g)+1/2I2(g) 的平衡常数K为
HI(g) 1/2H2(g)+1/2I2(g) 的平衡常数K为
A. 0.2 B.25 C. 1/25 D.0.02
16.250C时,下列四种溶液中,酸性最强的是
A. pH=14的溶液 B. c(OH-)=10×10-13 mol / L的溶液
C. 0.1mol.L-1的醋酸溶液 α=1.32%
D. pH=2的盐酸与pH=12的氢氧化钡溶液等体积混合
15.实验室用未知浓度的NaOH溶液滴定20.00ml0.1000mol.L-1HCl溶液,以测定NaOH溶液的浓度,下列有关判断正确的是
A.若碱式滴定管未用NaOH溶液润洗,则测定结果偏高
B.装标准盐酸的锥形瓶用标准盐酸润洗会使滴定结果偏高
C.取用标准盐酸的酸式滴定管未润洗会使测定结果偏高
D.滴定终点时俯视液面读数会使测定结果偏低
14.下列各项数据中,其比值是2:1的是
A.常温时PH等于7的氨水与硫酸铵的混和溶液中C(NH4+)与C(SO42―)之比
B.相同温度下,0.2mol/L CH3COOH溶液与0.1mol/LCH3COOH中C(H+)之比
C.H2S溶液中C(H+)与C(S2―)之比
D.PH=12的氨水与PH=12的Ba(OH)2溶液的物质的量浓度之比
13.0.1 mol.L-1下列溶液中阴离子数最多的是
A. KCl B. CH3COONa C. Na2CO3 D. MgSO4
12. 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
A.放电时负极反应为: Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时的正极在充电时须接电源正极
11.已知把金属M放入盐N(NO3)2溶液中,发生如下反应:M+N2+=M2++N,以下叙述正确的是
A.M和N用导线连接放入稀硫酸中,一定构成原电池,且N极上有H2产生
B.由M、N和N(NO3)2溶液构成的原电池中电流由M极经导线流向N极
C.由M、N和电解质溶液构成的原电池,一定是M作负极、N作正极
D.常温下金属M和N都不与水反应
10.已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ/mol。若向三份等体积、等物质的
量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将
上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是
A.Q1<Q3<Q2 B.Ql<Q2<Q3 C.Q1<Q2=Q3 D.Q1=Q2=Q3
9.已知A酸(HA)的酸性比B酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排列正确的是
A.c(OH-)>c(HA)>c(HB) >c(H+) B. c(OH-)>c(A-)>c(B-) >c(H+)
C. c(OH-)>c(B-)>c(A-) >c(H+) D. c(OH-)>c(HB)>c(HA) >c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com