
题目列表(包括答案和解析)
6.在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:



 ,
向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
,
向K2Cr2O7溶液中加入AgNO3溶液,发生离子交换反应,生成砖红色沉淀且溶液的pH下降,则生成的砖红色沉淀为
A.Ag2Cr2O7 B.Ag2CrO4 C.AgHCrO4 D.Ag2O
5.已知H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ·mol-1。若向三份等体积、等物质的量浓度的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3。下列关系式中正确的是
A.Ql<Q3<Q2 B.Ql<Q2<Q3 C.Q1<Q2=Q3 D.Q1=Q2=Q3
3.在中和热测定的实验中不需要用到的仪器是:
A.量筒 B.温度计 C.环形玻璃搅拌棒 D.天平
|
 A.C6H12O6(葡萄糖aq)+6O2
6CO2+6H2O
A.C6H12O6(葡萄糖aq)+6O2
6CO2+6H2O
B.CH3COOH+KOH = CH3COOK+H2O
C.A+B C+D
; △H<0
C+D
; △H<0
D.破坏生成物全部化学键所需能量小于破坏反应物全部化学键所需能量
2.下列说法正确的是:
A.食物在常温下腐败是自发进行的 B.凡是放热反应都是自发的
C.自发反应都是熵增大的反应 D.电解池的反应是属于自发反应
1.下列叙述正确的是:
A.强电解质都是离子化合物
B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,故SO3是电解质
D.硫磺是单质,不导电,因此硫磺是非电解质
26. (6分)在一定温度下,10L密闭容器中加入5molN2、25molH2,经10min后反应达平衡时有2molN2 ,
1)H2的转化率为多少?
第一节 用N2表示该反应的反应速率为多少?
第二节 平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
25. (8分)(09年浙江理综·27)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
1.
时间(s) |
2.
0 |
3.
1 |
4.
2 |
5.
3 |
6.
4 |
7.
5 |
|
8.
c(NO) 9. (mol/L) |
10.
1.00×10-3 |
11.
4.50×10-4 |
12.
2.50×10-4 |
13.
1.50×10-4 |
14.
1.00×10-4 |
15.
1.00×10-4 |
|
16. c(CO) 17. (mol/L) |
18.
3.60×10-3 |
19.
3.05×10-3 |
20.
2.85×10-3 |
21.
2.75×10-3 |
22.
2.70×10-3 |
23.
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H 0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)= 。
(3)在该温度下,反应的平衡常数K= 。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
24. (6分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
 (1)实验中观察到的现象是
(1)实验中观察到的现象是
。
(2)产生上述现象的原因是
。
(3)写出有关反应的离子方程式 。
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
23. (1)(3分)右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a到b过程中改变的条件可是:
;
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a到b过程中改变的条件可是:
;
b到c过程中改变的条件可能是 ;
若增大压强时,反应速度变化情况画在c-d处.

(2)(4分)反应2A B+C,在某一温度时,达到平衡
B+C,在某一温度时,达到平衡
① 若温度升高,化学平衡常数变小,则正反应是_____热反应。
② 若B是固体,降低压强时,平衡向左移动,则A是_____态。
③ 若A是气态,加压时,平衡不移动,则B为_____态,C为____态
21.(9分)化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡.
NH3+H2O 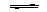 NH3·H2O
NH3·H2O
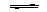 NH4++OH-
NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向__________移动,OH-的浓度__________, NH4+的浓度_____。 (2)向氨水中加入浓盐酸,平衡向___________移动,此时溶液中浓度减小的粒子有___________、___________、___________。 (3)向浓氨水中加入少量NaOH固体,平衡向______移动,此时发生的现象 _________ 。 22. (4分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式_____________________________________________________________,
若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) + 1/2O2(g) == H2O(l)的
△H=______________
kJ· 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com