
题目列表(包括答案和解析)
3. 现有乙酸和两种链状单烯烃混合物,其中氧的质量分数为a,则碳的质量分数是( )
A. 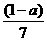 B.
B.
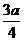 C.
C.
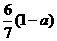 D.
D.
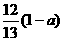
2.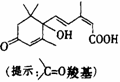 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
A.含有碳碳双键、羟基、羰基、羧基
|
C. 含有羟基、羰基、羧基、酯基
D. 含有碳碳双键、苯环、羟基、羰基
1. 下面的原于或原子团不属于官能团的是( )
A. NO3- B. -NO2 C. -OH D.
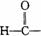
26.(7分)某工业纯碱中含有少量NaCl和NaOH。学生课外活动小组为测定其中Na2CO3的质量分数,采样进行分析。通过集体讨论,选择下列适当装置连接,对设计方案不断完善,成功地完成了测定实验。
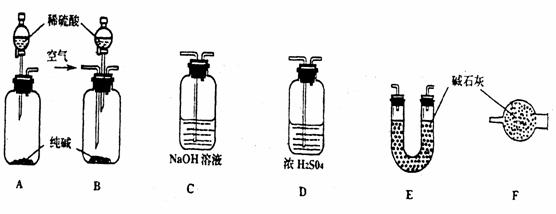
下面是甲、乙、丙、丁、戊五位同学有关设计实验装置的讨论发言。请在空白处填写他们的发言内容:
甲: 将装置A和E连接即可。因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,通过分别测量反应前和反应后E的总质量,可求出Na2CO3的质量分数。
乙: 还应在A和E之间连接装置_____(填序号),其目的是: _________________________
丙:应该用B装置取代A。从B装置的导管口处缓缓鼓入空气,其目的是:
_________________________________________________________________________
丁: 由于空气中含有CO2,若直接向B装置鼓入空气会导致实验测定结果__________(填“偏高”、“偏低”或“无影响”)。因此,应将鼓入的空气先通过装置________。
戊: E装置后还应连接装置F,其作用是___________________________________________
学生课外活动小组测定的数据如下:

计算该工业纯碱中Na2CO3的质量分数为: ___________
[相对原子质量:C-12 O-16 Na-23]
厦门六中2010-2011学年高二(下)期中考化学试卷
25.(12分)X、Y、Z、L、M五种短周期元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,其中X是原子半径最小的元素,L是地壳中含量最高的元素 。M是地壳中含量最高的金属元素。回答下列问题:*ks5*u
⑴Z的单质一个分子中含有____个π键 ; M的原子结构示意图为________________
(2)五种元素原子半径从大到小的顺序是________________________(用元素符号表示)
(3) Y、Z、L三种元素第一电离能由大到小的顺序是______________(用元素符号表示)
(4) Z、X两元素按原子数目比l∶3和2∶4分别构成分子A和B,A分子空间构型为___________,A分子中Z原子的轨道杂化方式为_______,B的结构式为______________。
(5) 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为_____________。
该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。[
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
23.(9分)胃舒平主要成分是氢氧化铝,同时含有三硅镁(Mg2Si3O8`H2O)等化合物。
(1)比较铝离子和镁离子半径大小(用离子符号表示)______________________。
(2)比较铝和镁的第一电离能大小__________________(用元素符号表示)
(3)下列事实不能说明镁比铝的金属性强的是____________
A.Al(OH)3可溶于强碱溶液中,Mg(OH)2不能
B.Mg能从铝盐溶液中置换出铝
C.Mg 原子最外层只有2个电子, 而Al原子最外层有3个电子
D.Mg与盐酸反应比铝与盐酸反应更剧烈
(4)已知:电负性: Mg- 1.2 Al- 1.5 Cl-3.0 。则MgCl2晶体中存在的作用力是__________;AlBr3属于_________(填“离子”或“共价”)化合物
(5)某元素与镁元素不同周期但在相邻主族,且性质和镁元素性质十分相似,该元素符号是___________,原子核外电子排布式为_____________________。
(6) Al2O3 、MgO都有很高的熔点,都可以制耐火材料,其原因是_____________________
______________________________________________________________________________
24(12分)X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)X的最高价氧化物固态时俗称“ ”,属于 晶体。该分子的空间构型是 。
(2)Y的价层电子(外围电子)排布式为 ,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(3)XY2是一种常用的溶剂,XY2的分子中存在 个σ键,属于 (填“极性”或“非极性”分子。
(4)在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(5)W的基态原子核外电子排布式是 。在W的二价硫酸盐溶液中通入过量的氨气,小心蒸发,最终得到的[W(NH3)4]SO4晶体中含有的化学键除了极性共价键外,还有 和 。
22.(9分)硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1).基态硅原子的核外电子排布式为 *ks5*u 。
(2).晶体硅的微观结构与金刚石相似,晶体硅中Si-Si键之间的夹角大小约为______。
(3).下面关于SiO2晶体网状结构的叙述正确的是( )
A..最小的环上,有3个Si原子和3个O原子
B.最小的环上,有6个Si原子和6个O原子
C.存在四面体结构单元,O处于中心,Si处于4个顶角
(4)下表列有三种含硅物质(晶体)的熔点:
|
物质 |
SiO2 |
SiCl4 |
SiF4 |
|
熔点/℃ |
1610 |
-69 |
-90 |
简要解释熔点差异的原因:
①SiO2和SiCl4:__________________________________________________________;
② SiCl4和SiF4:__________________________________________________________
________________________________________________________________。
(5)“神七”字航员所穿出仓航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由一种由硅及其同主族相邻短周期元素形成的化合物和碳纤维等复合而成的,它是一种新型无机非金属材料。该化合物的化学式为:________。已知该化合物的硬度仅次于金刚石,熔点比SiO2高,该化合物晶体属于________晶体[填“分子”、“原子”或“离子”。*ks5*u
21. (11分)碳是组成物质种类最多的元素。
(1)碳元素在元素周期表中的位置是第 周期 族。
碳有612C、613C、614C三种原子,它们互称为 。
(2)金刚石、石墨、C60三种碳单质互称为 。
C60的晶体类型是 ,金刚石中碳原子的轨道杂化方式是 ,
石墨晶体中存在的作用力有 。
(3)利用碳的低价氧化物CO可以合成化工原料COCl、配合物Fe(CO)5等。
①COCl分子的结构式为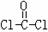 ,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
,分子中C原子的杂化轨道方式是_____________;按原子轨道重叠方式判断COCl分子中的化学键类型为___________________。
②Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断Fe(CO)5的晶体类型为 ;Fe(CO)5在一定条件下发生分解反应:Fe(CO)5 ==Fe(s)+5CO,反应过程中,断裂的化学键只有配位键。形成的化学键是_______________。
 金属铁单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为
。
金属铁单质的晶体在不同温度下有两种堆积方式,晶胞如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为
。
20.( ) 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,错误的是
A. X、M两种元素可以能形成两种离子化合物
B. 由于Y、Z、W元素的氢化物共价键的键能依次增大,氢化物的热稳定性依次增强
C. 化合物YM2和ZM2的晶体类型相同
D. H2M的沸点高于H2Z是因为形成分子间氢键的缘故*ks5*u
草稿
 厦门六中2010-2011学年高二(下)期中考
厦门六中2010-2011学年高二(下)期中考
--化学试卷
Ⅱ卷(非选择题, 60分)
19.( ) NA表示阿伏加德罗常数,下列叙述错误的是
A. 1mol N2和1mol CO所含电子数均为14NA
B.17g H2O2中含有的σ键数为1.5NA
C.1mol Na2O2固体中含离子总数为4 NA
D.1mol晶体硅中含有Si-Si键数为2 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com