
题目列表(包括答案和解析)
21. (7分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中会不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为_____________。
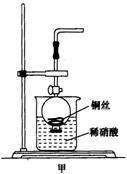
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是_________(填选项编号)。
A. 铁 B. 铝 C.银 D,玻璃 E. 聚丙烯塑料
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是___________________________________________
_________(填化学方程式)。
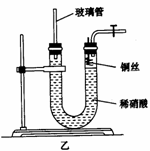
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U型管右端观察到无色的NO气体。
①长玻璃管的作用是_______________.
②让反应停止的操作方法及原因是______________________________________________.
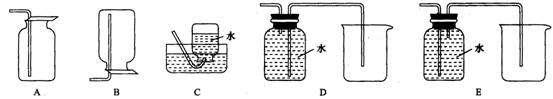
(4)以下收集NO气体的装置,合理的是__________(填选项代号)。
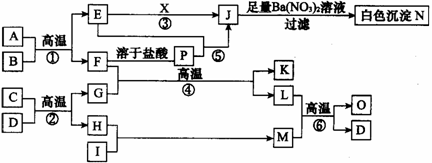
20.(8分)物质之间的转化关系如图所示,A可作为工业生产J的原料,B、C、H、I为非金属单质。常温下,X是一种液态化合物,F为常见的红棕色防锈油漆颜料的主要成分,O是常见含氮量最高的氮肥,A、E、J、N中含有同一种元素。
回答下列问题:
(1)X的化学式为_________,写出反应⑤的离子反应方程式为_______________。
(2)C+D的化学反应方程式为______________,在高温的条件下,向一个密闭容器中投入1molC和2molD,反应一段时间后,测得C的转化率为50%,则D的转化率为____________;这时混合气体的平均相对分子质量为______________。 www.k@s@5@ 高#考#资#源#网
(3)K和D在一定条件下反应也能生成H,写出其化学方程式为 ;
反应⑥的化学方程式为 .
 (4)现有1molA参加反应,假设各步反应均完全,生成N的质量为1165g,生成K的质量为224g,则反应①的化学方程式为 .
(4)现有1molA参加反应,假设各步反应均完全,生成N的质量为1165g,生成K的质量为224g,则反应①的化学方程式为 .
19. (5分)工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
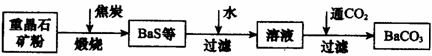
已知;BaSO4(s)+4C(s)===BaS(s)+4CO(g) △H=+571.2kJ·mol-1
Ba(s)+S(s)+2O2(g)====BaSO4(s) △H=-1473.2kJ·mol-1
Ba(s)+S(s)=BaS(s) △H=-460kJ·mol-1
请回答,
(1)C(s)和O2(g)反应生成CO(g)的热化学方程式为_______________________。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,应采取的措施是____________________________________。
(3)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq)。则:
①在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为______________________________________________________。
②与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有______ ______________________________。
③已知:Ksp(BaCO3)=2.8×10-9,Ksp(BaSO4)=1.07×10-10。现欲用沉淀转化法将0.39mol BaSO4全部转化为BaCO3,如每次用1.00L 2.0mol·L-1 Na2CO3溶液处理,至少需要处理_______次才能达到目的。
18.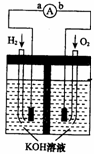 (8分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强、性质稳定。请回答:
(8分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强、性质稳定。请回答:
(1)氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向为________________.(用a、b表示)。
(2)负极反应式为____________;
(3)电极表面镀铂粉的原因为_______________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金屑锂是一种重要的储氢材料,吸氢和放氢原理如下:
I. 2Li+H2 2LiH
2LiH
Ⅱ. LiH+H2O==LiOH+H2↑
①反应I中的还原剂是_________,反应Ⅱ中的氧化剂是__________。
②已知LiH固体密度为0.82g/cm3,用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
17. (10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g)。
Si3N4(s)+6CO(g)。
(1)该反应的氧化剂是____________,其还原产物是_____________。
(2)该反应的平衡常数表达式为K=__________。
(3)若知上述反应为放热反应,则其反应热△H________0(填“>”“<”或“=”);升高温度,其平衡常数值_______(填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)=________。
(4)达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图。
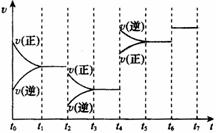
图中t4时引起平衡移动的条件可能是_______________;图中表示平衡混合物中CO的含量最高的一段时间是_______。
(5)若该反应的平衡常数为K=729,则在同温度下1 L密闭容器中,足量的SiO2和C与2molN2充分反应,则N2的转化率是多少?(写出计算过程,提示:272=729) www.k@s@5@ 高#考#资#源#网
|
|
J |
|
|
|
|
|
|
|
R |
|
16. (9分)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表,J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为____________;元素T在周期表中位于第_______族
(2)J和氢组成的化合物分子有6个原子,其结构简式为______________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为
__________________________.
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_________________________。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是__________(选填序号)。
|
选项 |
a |
b |
C |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
15. 基态原子的4能级中只有1个电子的元素共有( )
A. 1种 B. 2种 C. 3种 D. 8种
14. 贝诺酯是阿斯匹林、扑热息痛经化学法拼合制备的解热镇痛抗炎药,其合成反应式(反应条件略去)如下:
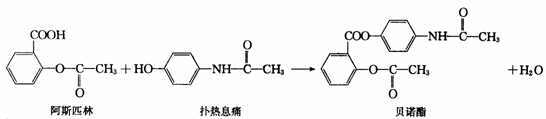
下列叙述错误的是( )
A. FeCl3溶液可区别阿斯匹林和扑热息痛
B. 1mol阿斯匹林最多可消耗2molNaOH
C. 常温下贝诺酯在水中的溶解度小于扑热息痛
D.C6H7NO是扑热息痛发生类似酯水解反应的产物 www.k@s@5@ 高#考#资#源#网
13. 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)
 2Z(g)+W(g)达到平衡时,VA=1.2a
L,则下列说法错误的是 ( )
2Z(g)+W(g)达到平衡时,VA=1.2a
L,则下列说法错误的是 ( )
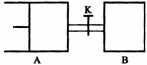 A. 反应开始时,B容器中化学反应速率快
A. 反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B容器中X的转化率大
C. 打开K一段时间达平衡时,A的体积为2.6a L(连通管中气体体积不计)
D. 打开K达新平衡后,升高B容器温度,A容器体积一定增大
12. N和H两种元素与C和H两种元素一样可以形成一系列的化合物。现将等物质的量的N2和H2置于一密闭容器中,在一定条件下发生反应mN2(g)+nH2(g)
 pZ(g);达到平衡时,测得容器中c(N2)=0.9mol·L-1,c(H2)=0.1 mol·L-1,c(Z)=0.8mol·L-1,则Z的化学式可能是 ( )
pZ(g);达到平衡时,测得容器中c(N2)=0.9mol·L-1,c(H2)=0.1 mol·L-1,c(Z)=0.8mol·L-1,则Z的化学式可能是 ( )
A.N2H3 B.NH3 C. N2H2 D.N3H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com