
题目列表(包括答案和解析)
25.在体积为1L的恒容容器中,反应2SO2+O2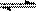 2SO3平衡后,SO2、O2、SO3的物质的量
2SO3平衡后,SO2、O2、SO3的物质的量
分别为2mol、1mol、2mol,维持温度不变,按如下改变物质的量后,平衡右移的是:
A.提取1mol SO2、1mol SO3 B.再加入1mol SO2、1mol O2、3mol SO3
C.再加入1mol SO2、1mol SO3 D.再加入2mol SO2、1mol O2、2mol SO3
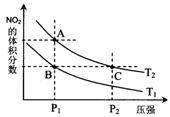
23.反应N2O4(g)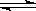 2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
A.A、C两点的反应速率:A>CB.A、C两点气体的颜色:A深,C浅C.由状态B到状态A,可以用加热的方法D.A、C两点气体的平均相对分子质量:A>C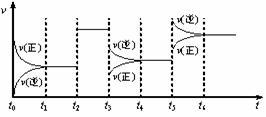 24.某密闭容器中发生如下反应:2X(g)+Y(g)
24.某密闭容器中发生如下反应:2X(g)+Y(g) 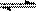 Z(g);△H <0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
Z(g);△H <0 下图是表示该反应的速率(v)随时间(t)变化的关系图,t2、t3、t5 时刻外界条件有所改变,但都没有改变各物质的用量。则下列说法中不正确的是
A.t3 时减小了压强 B.t5 时增大了压强
C.t6 时刻后反应物的转化率最低
D.t1 ~ t2 时该反应的平衡常数大于 t6 时反应的平衡常数
22.有编号为1、2、3、4的四瓶无色液体,仅知道是1%酚酞、0.1mol/LNaOH溶液、0.1mol/L盐酸和0.1mol/LNaCl溶液,现要求甲、乙、丙、丁四位学生进行鉴别,而且每人只鉴别两瓶溶液,告诉学生鉴别两瓶溶液都正确得满分,只有一瓶正确可以及格。四位学生的鉴别结果如下:
|
甲 |
1号为0.1mol/L盐酸 |
4号为0.1mol/LNaCl溶液 |
老师评价:四位学
生都及格,但是没
有一个得满分 |
|
乙 |
1号为0.1mol/LNaOH溶液 |
3号为0.1mol/L盐酸 |
|
|
丙 |
1号为1%酚酞 |
2号为0.1mol/L盐酸 |
|
|
丁 |
4号为0.1mol/L盐酸 |
2号为NaOH溶液 |
 正确的结论是
正确的结论是
A. 1号为1%酚酞
B.2号为0.1mol/LNaCl溶液
C. 3号为0.1mol/LNaOH溶液
D. 4号为0.1mol/L盐酸
21. 下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应 C(s)+H2O(g) 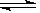 CO(g)+H2(g),当增加反应物的物质
CO(g)+H2(g),当增加反应物的物质
的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 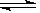 2NH3(g),当增大N2的浓度时,平衡向
2NH3(g),当增大N2的浓度时,平衡向
正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
20.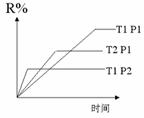 在密闭容器中进行下列反应:M(g) + N(g)
在密闭容器中进行下列反应:M(g) + N(g)  R(g) + 2L此反应符合右图,纵坐标表示R的体积分数。下列叙述正确的是
R(g) + 2L此反应符合右图,纵坐标表示R的体积分数。下列叙述正确的是
A.正反应吸热 ,L是气体
B.正反应吸热, L是固体
C.正反应放热 ,L是气体
D.正反应放热 ,L是固体或液体
19.下图表示反应X(g) 4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化曲线:
4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化曲线:
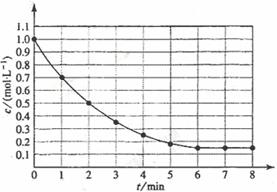
下列有关该反应的描述正确的是
A.第6min后,反应就终止了 B.若降低温度,v正和v逆将以同样倍数减小
C.若升高温度,X的平均转化率将大于85% D.X的平衡转化率为85%
18.对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
17.在2升的密闭容器中,发生以下反应:2A(g)+ B(g)  2C(g)+D(g)
。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)
。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A.2.8 mol B.1.6 mol C. 2.4 mol D. 1.2 mol
16.高温下,某反应达平衡,平衡常数K=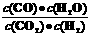 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应化学方程式为CO+H2O=CO2+H2
15.过氧化氢(H2O2)俗称双氧水,其性质不稳定,易分解。溶液的酸碱性、温度、光照程度都会影响其化学稳定性,大多数金属氧化物也可充当其分解的催化剂,而使其分解速率大大加快。双氧水中加入下列物质后,不能使其分解速率加快的是
A.CuO B.CaCl2 C.Fe2O3 D.MnO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com