
题目列表(包括答案和解析)
 3.利用课外活动时间在实验室用如图1-7所示装置进行实验,验证氨的某些性质,并收集少量纯净氮气。回答下列有关的问题:
3.利用课外活动时间在实验室用如图1-7所示装置进行实验,验证氨的某些性质,并收集少量纯净氮气。回答下列有关的问题:
(1)实验前先将仪器按上图连接好,然后检查装置的气密性。方法是向洗气瓶装置中的广口瓶加水,浸没进气导管口,用酒精灯在烧瓶下稍稍加热,若导管口有少量气泡产生,停止加热后,导管内水面上升形成一小段水柱,就可说明装置不漏气了,这个操作的错误之处是_______________________。
(2)实验进行一段时间后,观察到加热的硬质试管内黑色氧化铜粉末转变为红色,盛无水CuS04的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,写出在硬质试管内发生反应的化学方程式________________,这个反应说明NH3 具有 ________性。(A.氧化性 B.还原性 C.碱性 D.不稳定性)
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气,氨气产生的原因是________________________________。
(4)洗气瓶中盛浓硫酸的主要作用是________________;在最后出气的导骨口收集干燥、纯净的N2,收集方法是________________。
答案:(1)要先关闭分液漏斗的活塞
(2)2NH3+3CuO N2↑+3Cu+3H2O;B
N2↑+3Cu+3H2O;B
(3)生石灰溶于水放热,同时生成OH-,有利于NH3的逸出
(4)吸收氨气;用塑料袋和球胆收集
2.BGO是我国研制的一种闪烁晶体材料,曾被用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:
①在BGO中锗处于其最高价态;
②在BGO中铋的化合价与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8个电子的稳定结构;
③BGO可以看成是由锗和铋两种元素所形成的复杂氧化物,且在BCO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
(1)锗和铋的元素符号分别是________和________。
(2)BGO晶体的化学式为________。
(3)BCO晶体中所含铋的氧化物的化学式为________。
答案:(1)Ge;Bi (2)3GeO2·2Bi2O3 (3)Bi2O3
1.从某些方面看,氨和水相当,NH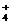 和H3O+相当,NH
和H3O+相当,NH 和OH-相当,NH2-(有时包括N3-)和(O2-相当。已知反应:HCl+NaOH=NaCl+H2O和NH4 C1+KNH2=KCl+2NH3都能进行,试完成下列反应方程式(M代表金属)。
和OH-相当,NH2-(有时包括N3-)和(O2-相当。已知反应:HCl+NaOH=NaCl+H2O和NH4 C1+KNH2=KCl+2NH3都能进行,试完成下列反应方程式(M代表金属)。
(1)NH4I+MNH→________________________。
(2)M+NH3→________________________。
(3)MO+NH4Cl→________________________。
(4)M(NH2)2→________________________。
答案:(1)2NH4I+MNH=MI2+3NH3
(2)M+2NH3=M(NH2)2+H2
(3)MO+2NH4C1=MCl2+2NH3↑+H2O
(4)M(NH2)2=MNH+NH3↑
14.在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,如图1-6所示加入的混合物与产生的气体体积的关系,试计算:
(1)NaOH的物质的量浓度为________。
(2)当NaOH溶液的体积为140mL时,固体混合物的质量是51.6g,充分反应后,生成气体的体积(标准状况)为________L。
(3)当NaOH溶液的体积为180mL时,固体混合物的质量仍为51.6g,充分反应后,生成气体的体积(标准状况)为________L。
答案:(1)5mol/L (2)15.68 (3)16.8
拓展练习
13.如图1-5所示装置a中充满干燥的氯气,将b中的浓氨水挤入a中,开始时a中发生氧化还原反应:NH3+Cl2→N2+HCl,同时生成白烟并发出红光。请回答下列问题:
(1)反应中生成的白烟是________。
(2)反应完成后,将a中的导管插入烧杯中的液面下并打开上水夹c,观察到有水吸人a瓶中形成喷泉,当喷泉停止后,升人a中的水约占a瓶容积的________。
 (3)标志a瓶中反应全部完成的化学方程式为________________________________。
(3)标志a瓶中反应全部完成的化学方程式为________________________________。
答案:(1)NH4Cl
(1) 
(3)8NH3+3C12=N2+6NH4C1
12.某学生课外小组用图1-4所示装置分别做如下实验:
(1)在试管中注入某红色溶液,加热试管,溶液的颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________;加热时溶液由红色逐渐变浅的原因是________________。
 (2)在试管中注入某五色溶液,加热试管,溶液变为红色,冷却后恢复五色,则此溶液可能是________;加热时溶液由无色变为红色的原因是________________。
(2)在试管中注入某五色溶液,加热试管,溶液变为红色,冷却后恢复五色,则此溶液可能是________;加热时溶液由无色变为红色的原因是________________。
答案:(1)氨水和酚酞;稀氨水中氨气逸出,所以溶液变浅
(2)溶有SO2的晶红溶液;SO2气体逸出,晶红溶液恢复红色
11.利用如图1-3所示装置收集以下8种气体:
①H2 ②Cl2 ③CH4 ④HCl
⑤NH3 ⑥NO ⑦H2S ⑧SO2
 (1)若烧瓶是干燥的,若由B口进气,可收集的气体有________;若改换由A口进气,可收集的气体有________。
(1)若烧瓶是干燥的,若由B口进气,可收集的气体有________;若改换由A口进气,可收集的气体有________。
(2)若在烧瓶内充满水,可收集到的气体有________,气体由________口进入。
(3)若在烧瓶内装入适量的浓硫酸,可以用它来干燥的气体有________,气体由________口进入。
答案:(1)②④⑦⑧;①③⑤ (2)①③⑥;A (3)①②③④⑥⑧;B
10.铵盐受热分解的过程就是铵根离子将质子转移给酸根离子的过程。对于相同类型的铵盐,可根据上述反应判断热稳定性。试比较NH4 F、NH4Cl、NH4Br、NH4l的热稳定性由强到弱的顺序是________________,其理由是________________。
答案:NH4I>NH4Br>NH4Cl>NH4F酸根阴离子半径越小,结合H+的能力越强,则该盐越不稳定,结合H+的能力F->Cl->Br->I-,所以盐的热稳定性NH4I>NH4Br>NH4Cl>NH4F
9.常温下由A和B两种物质组成的混合气体(A的式量大于B),经分析混合气体中只含氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于 。由此可以确定A为________,B为________,其理由是________________________。
。由此可以确定A为________,B为________,其理由是________________________。
答案:N2;NH3;纯氨中N和H的质量比为14:3,在纯氨中混入任何质量的N2,都将使混合气中N、H的质量比总大于14:3
8.下面是有关A、B、C、D四种化合物的实验记录,根据有关实验现象回答下列问题:
(1)写出A、B、C、D的化学式。
 A________、B________、C________、D________。
A________、B________、C________、D________。
答案:A(NH4)2SO4(或NH4HSO4) B:Ba(OH)2 C:H3SO4 D:BaCl2
(2)写出有关反应的化学方程式。
①A+B 的离子方程式:_______________________________
的离子方程式:_______________________________
答案:
②D+C F:_____________________
F:_____________________
答案:
③E+F G:_____________________
G:_____________________
答案:NH3+HCl=NH4Cl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com