
题目列表(包括答案和解析)
22.4 172
104 ×0.2% x
x=153.6kg
(2)如果将一定的尾气通人100mL2mol/L的NaOH溶液中使其完全反应,经测定所得溶液含16.7g溶质,试分析该溶液的成分,并计算各成分的物质的量。
答案:若溶液中溶质全部是Na2SO3:SO2+2NaOH=Na2SO3+H2O得12.6g
若溶液中溶质全部是NaHSO3:SO2+NaOH=NaHSO3得20.8g
今20.8g>16.7g>12.6g,该溶液成分为Na2SO3和NaHSO3,n(NaHSO3)=0.1mol,n(Na2SO3)=0.05mol
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3。调节尾气排放量,以取得SO2与NaOh间物质的量的最佳比值,从而提高NaHSO3 的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且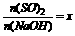 试写出x在不同的取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
试写出x在不同的取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
答案:
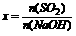 |
n(NaHSO3) |
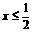 |
0 |
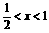 |
n(NaHSO3)=2n(SO2)-n(NaOH) |
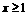 |
N(NaHSO3)=n(NaOH) |
3.接触法制硫酸排放的尾气中含少量的SO2,为防止污染大气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放1×104m3尾气中含0.2%(体积分数)的OS2。问用NaOH溶液、石灰及O2处理后,假设硫元素不损失,理论上可得多少千克石膏(CaSO4·2H2O)?(气体体积已换算成标准状况下的体积)
答案:设CaSO4·2H2O的质量为x
SO2---CaSO4·2H2O
2.化学需氧量(COD)是水体质量控制的标准之一,它是量度水中还原性物质的重要指标。COD指用强氧化剂(我国使用K2Cr2O7)处理一定量的水样所消耗氧化剂的量,并换算成以O2作氧化剂时,1L水样所消耗O2的质量(mg/L)。
现有某废水样品20.00mL,加入10.00mL0.0400mol/L的K2Cr2O7溶液,并加入适量的酸性催化剂-,加热反应2小时,在指示剂存在的条件下用0.100 0mol/L的Fe(NH4)2(SO4)2溶液滴定多余的K2Cr2O7,共用去Fe(NH4)2(SO4)2溶液12.00mL。
(1)已知K2Cr2O7在酸性溶液中作氧化剂时,还原成Cr3+,Fe2+氧化为Fe3+。写出K2CrCr2O7与Fe(NH4)2(SO4)2在H2SO4存在下反应的化学方程式。
(2)计算20.00mL废水所消耗的K2Cr2O7的物质的量。
(3)计算废水水样的COD。
(4)社会调查:在锻造、机械、印染、造纸、电镀、蓄电池等工厂所排放的污水中,COD值特别高的是哪些工厂?
答案:(1)K2Cr2O7+6Fe(NH4)2(SO4)2+7H2SO4=3Fe2(SO4)3+6(NH4)2SO4+Cr2(SO4)3+K2SO4+7H2O
(2)消耗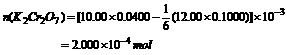
(3)废水水样的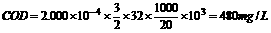
(4)印染厂和造纸厂。
1.工业上常用漂白粉跟酸反应放出Cl2的质量对漂白粉质量的百分比(x%)来表示漂白粉的优劣。漂白粉与酸反应的化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2↑+2H2O
现为了测定一瓶漂白粉的x%进行如下实验:称取漂白粉样品2.00g,加水研磨后稀释到250mL。取出25mL,加入过量的KI溶液和过量的稀H2SO4,静置。待漂白粉放出的Cl2与KI完全反应后,用含有硫代硫酸钠的溶液(Na2S2O3)滴定反应中生成的碘单质,反应的化学方程式如下:
2Na2S2O3+I2=Na2S4O6+2NaI
滴定到反应恰好完全时,用去的Na2S2O3溶液中含Na2S2O3为0.316g,试由上述数据计算该漂白粉的x%。
答案:1.35.5%
15.现有氧化铜和炭粉的混合物共Amol,将它在隔绝空气的条件下加热。反应完全后冷却,得到残留固体。
(1)写出可能发生反应的化学方程式;
答案:(1)2CuO+C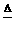 2Cu+CO2,CuO+C
2Cu+CO2,CuO+C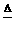 Cu+CO
Cu+CO
(2)若氧化铜在混合物中物质的量之比为x(0<x<1),问:当x为何值时,残留固体为何物?写出残留固体的物质的量与x值之间的关系,将结果填人下表:
|
x |
残留固体 |
|
化学式 |
物质的量 |
|
|
|
答案:
|
x |
残 留 固 体 |
|
|
化 学 式 |
物 质 的 量 |
|
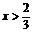 |
Cu、CuO |
2A(1-x)、A(3x-2) |
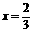 |
Cu |
Ax(或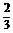 A) A) |
 |
Cu |
Ax |
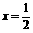 |
Cu |
Ax(或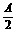 ) ) |
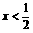 |
Cu、C |
Ax、A(1-2x) |
拓展练习
14.用36.5%(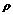 =1.18g/cm3)的盐酸与足量的MnO2反应,将生成的气体通入500mLNa2SO3溶液中,气体被吸收了90%,并同时收集到8.461L(标准状况下)混合气体。向该溶液中加入少量的4mol/L的BaCl2溶液200mL,过滤,再向溶液中加入足量的AgNO3九溶液,结果得到干燥的白色沉淀430.5g。试求:
=1.18g/cm3)的盐酸与足量的MnO2反应,将生成的气体通入500mLNa2SO3溶液中,气体被吸收了90%,并同时收集到8.461L(标准状况下)混合气体。向该溶液中加入少量的4mol/L的BaCl2溶液200mL,过滤,再向溶液中加入足量的AgNO3九溶液,结果得到干燥的白色沉淀430.5g。试求:
(1)有多少毫升盐酸被氧化?
(2)原Na2SO3溶液的物质的量浓度是多少?
答案:(1)V(HCl)=132mL (2)c(Na2SO3)=2.0mol/L
13.在标准状况下,进行甲、乙、丙三组实验:三组各取30mL同浓度的盐酸溶液,加入同一种mg、Al合金粉末,产生气体,有关数据列表如下:
实验序号 甲 乙 丙
合金质量(mg) 255 385 459
生成气体体积(mL) 280 336 336
(1)甲组实验中,盐酸(填“过量”、“适量”或“不足量”)________________,理由是________________________;乙组实验中,盐酸(填“过量”、“适量”或“不足量”)________,理由是________________________________;要算出盐酸的物质的量浓度,题中可作为计算的数据是________,求得盐酸的物质的量浓度为________________。
答案:(1)过量;乙组所用的合金比甲组多,产生的H2也多不足量;从甲组实验可知,每克合金产生H2的体积为 mL,若乙组合金耗尽,应产生H2为
mL,若乙组合金耗尽,应产生H2为 ×385=423mL,实际只生成了336mL,说明乙组盐酸不足量;336mL,30mL;lmol/L
×385=423mL,实际只生成了336mL,说明乙组盐酸不足量;336mL,30mL;lmol/L
(2)求合金中Mg、Al的物质的量之比,题中可作为计算依据的数据是________________,求得Mg、Al的物质的量之比为________________。
答案:255mg,280mL;1:1
12.已知反应:S2O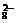 +2e-=2SO
+2e-=2SO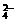 ,Mn2++4H2O=MnO
,Mn2++4H2O=MnO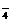 +8H++5e-,则氧化lmolMn2+需S2O
+8H++5e-,则氧化lmolMn2+需S2O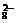 的物质的量为________________。Mn2+与S2O
的物质的量为________________。Mn2+与S2O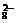 在水溶液中发生氧化还原反应的化学方程式为________________________。
在水溶液中发生氧化还原反应的化学方程式为________________________。
答案:2.5mol;2Mn2++5S2O82-+8H2O=108O42-+2MnO4-+16H+
11.在两个密闭容器中分别盛有31g白磷和lmolO2 ,控制条件使其发生反应:容器甲:P4+5O2=P4O10;容器乙:P4+3O2=P4O6,充分反应后,两容器中分别所得P4O10 和P4O6的物质的量之比为________________。
答案:4:5
10.有一白色固体,取少量于试管中加热,固体逐渐消失,放出水蒸气和其他两种气体,试管内除少量水珠外无任何残留物。取这种固体0.350g跟过量的烧碱反应,生成一种能使湿润的红色石蕊试纸变蓝的气体,这些气体正好和30.0mL0.1mol/L的H2SO4完全反应;另取这种固体0.350g跟足量的盐酸反应,放出一种无色无味的气体,将这些气体通入过量的澄清石灰水中,得到白色沉淀0.400g。原白色固体的成份是_____________,原白色固体中各成份的物质的量之比为________________。
答案:(NH4)2CO3和NH4HCO3;1:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com