
题目列表(包括答案和解析)
1.有一种供婴儿使用的一次性纸质尿布--“尿不湿”,其中含有一层既能吸水又能保留水的物质,据你推测,该物质可能是( )。

答案:B
2.在763K、3.04×104kPa时,用CO和H2作为原料合成CH3OH,存在下列平衡:
CO(气)+2H2(气)⇌CH3OH(气)
当原料中H2和CO的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响。
(1)设H2和CO的起始物质的量之比为m,平衡时CO的转化率为a,平衡混合物中甲醇的体积分数为y,试推断m、a、y,三者的相互关系并以y=f(d,m)的函数表达式表示出来。
答案: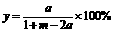
(2)将下表已知数据代人导出的表达式中进行计算,把计算结果填人表中有关空格中:
|
m |
a |
Y |
|
1 |
0.25 |
|
|
2 |
0.45 |
|
|
3 |
|
19.35% |
答案:
|
m |
a |
y |
|
1 |
0.25 |
16.67% |
|
2 |
0.45 |
21.43% |
|
3 |
0.56 |
19.35% |
(3)根据上表数据,判断用CO和H2合成甲醇时,H2和CO的最佳体积比是多少?并简述依据。
答案:分析上表中数据不难看出,当,m=2时,CO的转化率较大,此时平衡混合气中CH3OH的体积分数最高
 最佳比为H2:CO=2:1
最佳比为H2:CO=2:1
1.为了除去工业废气中的SO2,可将SO2转化成(NH4)2SO4。据有关资料介绍,摘录如下:
“初步处理后的废气中含0.2%的SO2(体积分数),10%的O2(体积分数),在400℃时,以5m3/h的速度通过V2O5触煤层,然后与流量为25L/h的NH3混合,再喷入流量为290g/h的水,此时气体温度迅速从400℃下降至200℃,在热的结晶的装置中得到(NH4)2SO4晶体。”据此资料回答下列问题:
(1)按反应式2SO2+O2⇌2SO3,SO2与O2的物质的量之比为2:1,资料中却用1:50,原因是______________________________。
(2)进行冷却的原因是______________________________。
(3)某工厂废气中含0.4%的SO2和0.5%的O2,你认为该怎样利用上述资料?答:____________________。
(4)如果某工厂没有NH3,只有生石灰,你认为又该怎样利用上述资料?答:______________________________。
(5)若将SO2全部转化为SO3,SO3全部转化成(NH4)2SO4,则资料中NH3的每小时通入量至少应是__________L,由此可得出NH3的利用率为__________。
答案:(1)增大O2的浓度,提高SO2的转化率
(2)降温有利于生成(NH4)2SO4,高温(NH4)2SO4会分解
(3)O2的量不足,向废气中增大空气的量
(4)用生石灰代替NH3
(5)20;80%
10.合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜
(I)溶液来吸收原料气中的CO,其反应是:
[Cu(NH3)2]Ac+CO+NH3⇌[Cu(NH3)3]Ac·CO(正反应为放热反应)
(1)必须除去原料气中CO的原因是____________________。
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件应是____________________。
(3)吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨液再生的生产适宜条件应是____________________。
答案:(1)防止催化剂中毒
(2)低温、加压 (3)高温、低压
拓展练习
9.在一定条件下,把3mo1N2和3molH2通入一个定容的密闭容器中,发生如下反应:N2+3H2⇌2NH3,当反应达到平衡状态,容器内的压强为P。若在上述完全相同的容器中,温度仍不变,通入1.OmolNH3、__________molN2和__________molH2,才能使容器内的压强仍为P。平衡时N2物质的量的取值范围在__________mol至__________mol之间,NH3的量在__________mol至__________mol之间。若达到平衡时,H2和NH3均为1.5mol,你认为可能吗?__________(填“可能”或“不可能”)。
答案:2.5;1.5;2;3;0;2;不可能
8.在硫酸工业中,通过下列反应使SO2转化为SO3:
2SO2+O2 2SO3(正反应为放热反应)
2SO3(正反应为放热反应)
已知常压下平衡混合气体中SO3的体积分数为91%。试回答:
(1)在生产中常用过量的空气,是为了__________;
答案:增大O2浓度,提高SO2的转化率
(2)加热到400℃-500℃,是由于__________;
答案:保证催化剂活性达到所需要的最佳温度,以提高反应速率,缩短达到平衡所需要的时间
(3)压强采用__________,原因是______________________________;
答案:常压;常压下平衡混合气中SO3的体积分数已达到91%,若再加压,对设备及动力系统要求高,成本高
(4)常用浓H2SO4来吸收SO3而不用水,是因为____________________;
答案:用水吸收SO3易形成酸雾,吸收速率慢
(5)尾气中的SO2必须回收,是为了____________________。
答案:减少对环境的污染
7.CO2和H2的混合气体加热到850℃时,可建立下列平衡:
CO2+H2⇌CO+H2O
在一定温度下,反应平衡时有90%的氢气变成水,且[CO2]·[H2]=[CO]·[H2O],则原混合气体中CO2和H2的分子数之比是( )。
A.1:1 B.5:1 C.9:1 D.1:10
答案:C
6.在相同条件下(T=500K),有相同体积的甲、乙两容器,甲容器中充入1gSO2和1gO2,乙容器中充入2gSO2和2gO2,下列叙述中错误的是( )。
A.化学反应速率:乙>甲 B.平衡后O2的浓度:乙>甲
C.SO2转化率:乙>甲 D.平衡混合气中SO2的体积分数:乙>甲
答案:C
5.两密闭容器a、b开始时体积相同,a保持压强不变,b保持容积不变,在相同温度下装入同比例混合且质量相等的H2和N2的混合气体,并保持温度不变。当反应达到平衡时,a容器中N2的转化率为12%,则此时b容器中N2的转化率是( )。
A.大于12% B.小于12% C.等于12% D.无法确定
答案:B
4.将一定质量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(固)  Ag2O(固)+SO3(气)
Ag2O(固)+SO3(气)
2SO3(气)  2SO2(气)+O2(气)
2SO2(气)+O2(气)
经10min后,反应达到平衡时,[SO3]=0.4mol/L,[SO2]=0.1mol/L。别下列叙述中不正确的是( )。
A.SO3的分解率为20% B.10min内 (O2)=0.005mol/(L·min)
C.容器内气体的密度为40g/L。 D.加压,容器内固体的质量不变
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com