
题目列表(包括答案和解析)
2.已知反应AsO43-+2I-+2H+⇌AsO33-+I2+H2O是可逆反应。现设计图4-10所示的实验装置,进行下述操作:(Ⅰ)向B烧杯中逐滴加入浓盐酸, 发现微安表指针偏转;(Ⅱ)改向B烧杯中滴入40%的NaOH溶液,发现微安表指针向相反方向偏转。试回答下列问题:
(1)两次操作过程中指针为什么会发生偏转? _________________________________。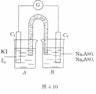
(2)两次操作过程中指钊偏转方向为什么相反?试用化学平衡移动原理解释。___________。
(3)(Ⅰ)操作过程中,C1棒上发生的电极反应式为____________________________________________。
(4)(Ⅱ)操作过程中,C2棒上发生的电极反应式为______________________。
答案:(1)当加入酸或碱时,化学平衡移动使化学能转化为电能
(2)当向B中加入盐酸时,化学平衡右移,I-失电子,C1为负极,电子由C1经导线流人C2;当向B中加入NaOH时,化学平衡左移,A sO33-失电子,C2为负极,电子由C2经导线流人C1,故两次操作微安表指针偏移方向相反
(3)2I--2 e-=2e-=I2 (4)AsO33-+2OH--2e-=AsO43-+H2O
1.A、B、C、D是四种短周期元素,它们的原于序数依次增大,其中A、C及B、D分别为同族元素;又知B、D两元素原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中有两种是气体,两种是固体。
(1)写出由B、C两种元素所形成的原子个数比为1:1的化合物的电子式___________,其晶体中存在的化学键的种类有___________。
(2)写出两种均由A、B、C、D四种元素所组成的化合物的化学式___________,这两种化合物的水溶液发生离子反应的方程式为___________。
(3)用A元素的单质和B元素的单质可制成新型的化学电源,已在美国阿波罗宇宙飞船中使用。其构造如图4-9所示。两个电极均由多孔性炭制成,通人气体由孔隙中逸出,并在电极表面放电。
①a是___________极,电极反应式为___________;
②b是___________极,电极反应式为___________;
(4)已知每生成1mol的液态A2B放出286kJ的热量。又知该电池发1度电能生成350g的A2B,则该电池的能量转化率为___________。
答案:(1)Na+[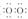 ]2-Na+;离子键,非极性共价键
]2-Na+;离子键,非极性共价键
(2)NaHSO3、NaHSO4;HSO3-+H+=H2O+SO2↑
(3)①负;2H2+4OH--4e-=4H2O;
②正;O2+2H2O+4e-=4OH-
(4)1度电即3600kJ
能量转化率=3600kJ÷( ×286kj/mol)=64.7%
×286kj/mol)=64.7%
14.有一硝酸盐晶体的化学式为M(NO3)x·nH2O,经测定其摩尔质量为242g/mol,取1.21g此晶体溶于水,配制成100mL溶液,将其置于电解槽中用惰性电极进行电解,当有0.01mol电子通过电极时,溶液中的全部金属离子都在电极上析出,经测定阴极增重0.32g,求:
 (1)L21g此晶体是多少摩?x值是多少?
(1)L21g此晶体是多少摩?x值是多少?
(2)金属M的相对原子质量和n值。
(3)如果电解过程中溶液的体积不变,计算电解后溶液的pH。
答案:(1)0.005mol;x=2 (2)64;n=3 (3)pH=1
拓展练习
13.剪约6cm长、2cm宽的铝片、铜片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm)。将Cu片和Al片分别与电流表的“+”、“-”端连接,电流表指针调到中间位置。取两个小烧杯,在一个烧杯中注入40mL浓硝酸,在另一烧杯中注入40mL0.5mol/L的稀H2SO4。试回答下列问题:
(1)两电极同时插入稀H2SO4中,电流计指针偏向___________极(填“铝”或“铜”),铝片上的电极反应式为___________;
(2)两电极同时插入浓HNO3,电流计指针偏向___________极(填“铝”或“铜”),此时铝是m极(填“正”或“负”),铝片上的电极反应式为___________。
答案:(1)铝;Al-3e-=A13+ (2)铜;正;NO3-+4H++3e-=NO+2H2O(Al钝化)
12.富有经验的木工在向木器钉铁钉时,习惯用口水把铁钉尖部润湿,然后钉入木器,其目的有两个,一是___________,二是______________________。
答案:起润滑作用,有利于铁钉的钉人;加速铁钉的生锈,使铁钉不易脱落
11.有人设计以铂和锌为电极材料,埋入人体内做某种心脏病人的心脏起搏器的能源,它依靠人体内血液中有一定浓度的O2和H2O进行工作,其正极材料是___________,电极反应式为___________;负极材料是___________,电极反应式为___________。
答案:Pt;O2+2H2O+4e-=4OH-;Zn;Zn-2e-=Zn2+
10.(1)如今有2H2+O2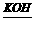 2H2O反应,构成燃料电池,则负极通的气体应是___________,正极通的气体应是___________,电极反应式分别为______________________ 。
2H2O反应,构成燃料电池,则负极通的气体应是___________,正极通的气体应是___________,电极反应式分别为______________________ 。
(2)如把KOH改为稀H2SO4作电解质,则电极反应式分别为___________;(1)和(2)的电解液不同,反应进行后,其溶液的pH各有何变化?___________。
(3)如把H2改为甲烷,KOH作导电物质,则电极反应式为______________________。
答案:(1)H2;O2;负极:2H2+4OH‑-4e-=4H2O,正极:O2+2H2O+4e-=4OH-
(2)负极:2H2-4e-=4H+,正极:O2+4e-+4H+=2H2O;(1)变小(2)变大
(3)负极:CH4+100H--8e-=CO32-+7H2O,正极:2O2+4H2O+8e-=8OH-
9.我国首先研制的以铝___________空气___________海水电池为能源的新型航标灯已研制成功。这种灯以取之不尽的海水为电解质溶液,靠空气中的O2使铝不断氧化而源源产生电流,只要把灯放入海水中数分钟,就会发出耀眼的闪光,其能量比干电池高20-50倍。试推断这种新型电源的基本结构:___________是负极,___________是正极,电极反应式为______________________。
答案:铝;铁或碳;负极:4Al-12e-=4A13+,正极:3O2+12e-+6H2O=12OH-
8.将锌片和碳棒连接,浸入NH4Cl溶液中,也可以产生电流,此时正极为___________,电极反应式为 ___________,负极为___________,电极反应式为___________。
答案:C;2H++2e-=H2;Zn;Zn-2e-:Zn2+
7.一种以多孔铂片作电极,以KOH溶液为电解质溶液的CH4燃料电池中,两极发生的电化学反应:R极:CH4-8e-+100H-→CO32-+7H2O;S极:2O2+8e-+4H2O=8OH-,下列关于CH4燃料电池的各项叙述中肯定不正确的是( )。
A.通人CH4的R极是电池的正极,发生氧化反应;通人O2的S极是电池的负极,发生还原反应
B.该燃料电池每通入2.8L(标准状况下)甲烷时,将有1.0mol的电子产生
C.该燃料电池属于碱性电池,在使用过程中KOH的物质的量保持不变
D.该燃料电池在使用过程中,在S极附近的pH将会升高
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com