
题目列表(包括答案和解析)
22.盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中阴离子只有CO 和OH-
和OH-
B.NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C.10 mL0.10mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
21.下列有关金属腐蚀与防护的说法正确的是
A.纯银器表面在空气中主要因电化学腐蚀而渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
20. 爱迪生电池在充电和放电时发生的反应:Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,
爱迪生电池在充电和放电时发生的反应:Fe+ NiO2+2H2O Fe(OH)2+Ni(OH)2,
下列该蓄电池推断错误的是:
① 放电时,Fe参与负极反应,NiO2参与正极反应
② 充电时,阴极上的电极反应式为:Fe(OH)2 + 2e-= Fe + 2OH-
③ 放电时,电解质溶液中的阴离子向正极方向移动
④ 放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
⑤ 蓄电池的电极须浸入某种碱性电解质溶液中
A.只有③ B.③④ C.④⑤ D.①②⑤
19.电解100mL含 C(H+)=0.30 mol·L-1的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是
A.0.10 mol·L-1Ag+ B.0.02 mol·L-1Zn2+
C.0.20 mol·L-1Cu2+ D.0.20 mol·L-1 Pb2+
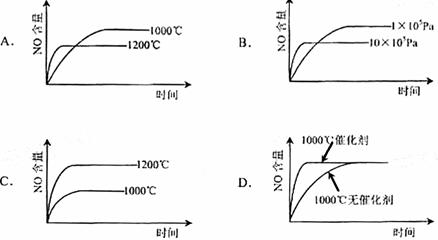
18.已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025kJ·mol-1该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
17.室温时,若0.1 mol·L-1的一元弱碱的电离度为1%,则下列正确的是
A.该溶液的pH=11
B.该溶液的pH=3
C.加入等体积0.1 mol·L-1HCl后所得溶液的pH=7
D.加入等体积0.1 mol·L-1HCl后所得溶液的pH>7
16.高温下,某反应达平衡,平衡常数 恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应化学方程式为CO+H2O CO2+H2
CO2+H2
B.该反应的焓变为正值
C.恒温恒容下,增大压强,H2浓度一定减小
D.升高温度,逆反应速率减小
15.某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液中由水电离产生的H+浓度可能大于10-7 mol·L-1
B.该溶液可能由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
C.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
D.加入适量的NaOH,溶液中离子浓度可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
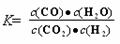
14.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
A.CH3OH -2e-+O2=H2O+CO2+2H+
B.O2+4H++ 4e-=2H2O
C.CH3OH -6e-+H2O=CO2+6H+
D.O2+2H2O+4e-=4OH-
13.下列事实不能用勒夏特列原理解释的是
A.实验室可以用排饱和食盐水的方法收集氯气
B.将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
C.高压有利于工业上合成氨
D.打开汽水瓶时,瓶中立即泛起大量泡沫
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com