
题目列表(包括答案和解析)
4.已知乙烯分子呈现平面结构且碳碳双键(C=C)不能旋转,因此1,2-二氯乙烯可以形成
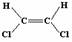
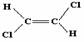
和 两种不同的空间异构体。下列各物质中,能形成类似上述两种空间异构体的是( )
A.CH2=CCl2 B.CH3CH=CH2 C.CH3CH2CH=CH2 D.CH3CH=CHCH3
3.只用水就能鉴别的物质组是( )
A.苯、乙酸、CCl4 B.乙醇、乙醛、乙酸
C.乙二醇、乙醛、溴代烃 D.乙醇、甘油、苯酚
2.下列物质①无水乙醇 ②乙酸 ③石炭酸 ④苯,其中能够与钠反应放出氢气的物质是( )
A.①② B.①②③ C.③④ D.②③④
1.某同学写出下列烷烃的名称中,正确的是( )
A.3, 3 -二甲基丁烷 B.2, 2 -二甲基丁烷 C.2-乙基丁烷 D.2, 3, 3 -三甲基丁烷
28.(10分)在一定温度下有甲、乙两容积相等的密闭容器(两容器容积保持不变)。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3 amol。此时,NH3的物质的量分数是________。(用含有“a”的表达式表示)。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将________(选填“增大”、“减小”或“不变”)。
(2)向乙中通入2mol NH3,欲使反应达到平衡时,各物质的浓度与(1)中第一次平衡时相同,则起始时还需通入________mol N2和________mol H2。
(3)若起始时,向乙中通入6mol N2和8mol H2,达到平衡时,生成的NH3的物质的量为b mol,
(选填“>”、“<”或“=”)。
27.(13分)
Ⅰ(7分)从某铝镁合金片上剪下一小块(质量为2.0g),立即投入到盛有20mL5mol·L-1NaOH溶液的小烧杯中。
(1)开始时产生气泡的速率较慢其原因是 ,一段时间后反应速率相当快原因是 (2)写出合金片与溶液反应时可能形成的原电池的负极材料是 ,正极电极反应方程式为 .
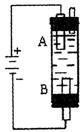 Ⅱ(6分)某同学设计了一种电解法制取
Ⅱ(6分)某同学设计了一种电解法制取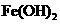 的实验装置(如右图)。玻璃管内的电解液为
的实验装置(如右图)。玻璃管内的电解液为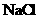 溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
溶液,通电后,溶液中产生白色沉淀,且较长时间不变色。回答下列问题:
(1)写出A电极的电极反应式 B电极的电极反应式
(2)若电解改用 溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用
溶液作电解液,发现电解一开始即出现灰绿色沉淀试分析为什么用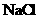 溶液作电解液时白色沉淀能保持较长时间的原因
溶液作电解液时白色沉淀能保持较长时间的原因
26.(8分)在25mL 0.1 mol·L-1的NaOH溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,溶液pH变化曲线如图所示。
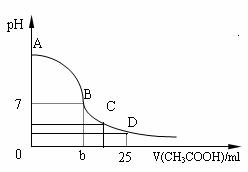
(1)B点溶液呈中性,有人据此认为,在B点时NaOH溶液与CH3COOH溶液恰好完全反应,这种看法是否正确? (填“是”或“否”),如果不正确,则二者恰好完全反应的点是在 (填“AB”、“BC”或“CD”)区间内。
(2)在D点时,溶液中C(CH3COO-)+C(CH3COOH) 2C(Na+)(填“>”、“<”或“=”)。
(3)在C点时,溶液中离子浓度由大到小的顺序: 。
25.(13分)维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6。维生素C易被空气中的氧气氧化。在新鲜的水果,蔬菜,乳制品中都富含有维生素C,如新鲜橙汁中维生素C的含量为500mg·L-1左右。某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量,下面是测定分析的实验报告:
(1) 测定目的:测定XX牌软包装橙汁中维生素C的含量。
(2) 测定原理:C6H8O6 + I2 → C6H6O6 + 2H+ + 2I- 。
(3) 实验用品:
① 实验仪器:酸式滴定管,铁架台,锥形瓶,滴管等。
② 试剂:指示剂 (填名称),7.5×10-3mol·L-1标准碘液,蒸馏水。
(4) 实验步骤:
① 洗涤仪器:检查滴定管是否漏水,润洗好后装好标准碘液。
② 打开软包装橙汁,目测颜色(橙黄色,澄清度好),用 (填仪器名称)向锥形瓶中移入20.00ml待测橙汁,滴入2滴指示剂。
③ 用左手控制滴定管的 (填部位),右手摇动锥形瓶,眼睛注视
直到滴定终点,判断滴定终点的现象是
④ 记下读数,再重复操作两次。
(5)数据记录处理,若经数据处理,滴定中消耗标准碘溶液的体积是15.00ml,则此橙汁中维生素C的含量为 mg·L-1。从最终测定的含量来看,测定的橙汁是天然橙汁吗? (填“是”或“否”)
(6)误差分析:若在实验中存在下列操作,其中会使维生素C的含量偏低的是
A量取待测橙汁的仪器水洗后未润洗
B锥形瓶水洗后未用待测液润洗
C滴定前尖嘴部分有一气泡,滴定终点时消失
D滴定前仰视读数,滴定后俯视读数
E在滴定过程中剧烈震荡锥形瓶
24.(10分)
Ⅰ(4分)同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算。
已知:P4(s,白磷)+5O2(g)= P4O10(s) △H=-2983.2kJ·mol-1 ①
P(s,红磷)+O2(g)=P4O10(s) △H=-738.5kJ·mol-1 ②
(1)试写出白磷转化为红磷的热化学方程式_______________________ ______。
(2)由热化学方程式来看,更稳定的磷的同素异形体是_____________________________。
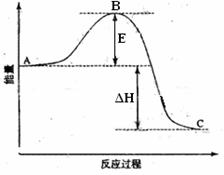 Ⅱ(6分)2SO2(g)+O2(g)
Ⅱ(6分)2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1.请回答下列问题:
(1)图中E的大小对该反应的反应热有无影响? 。(填“有影响”或“无影响”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? (填“升高”或“降低”)
(2)图中△H= kJ·mol-1.。
23.Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生反应并达到平衡(X、Y状态未知):
aX(?)+2Y(?) 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是( )
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是( )
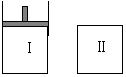 A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X物质的量:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积分数变大
二:填空题(共54分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com