
题目列表(包括答案和解析)
4.下列比较中正确的是( )。
A.硝酸的酸性比磷酸强 B.PH3的稳定性大于NH3
C.PH3的还原性大于NH3 D.氮气的化学性质比磷活泼
答案:AC
3.各取0.1mol的Cu分别投入到足量的下列四种酸溶液中(必要时可以加热):①浓硫酸 ②浓硝酸 ③稀硝酸 ④稀硫酸,充分反应后得到气体的体积(相同条件下)由大到小的顺序是( )。
A.①②③④ B.②①③④ C②④①③ D.③④①②
答案:B
2.在常温下都不被浓硝酸腐蚀的一组金属是( )。
A.Pt、Zn、H B.Cu、Ag、Sn C.Fe、Pb、Ba D.Al、Fe、Au
答案:D
1.下列关于浓硫酸和浓硝酸的叙述中正确的是( )。
A.常温下都能用铝容器贮存 B.露置在空气中,容器中酸液的质量都减少
C.常温下都能与铜粒反应 D.露置在空气中,容器中酸液的质量都增加
答案:A
27.(7分)常温下,向20mL硫酸和盐酸混合溶液中加入0.05mol/L的Ba(OH)2
溶液时,生成BaSO4沉淀量及溶液pH发生如下图所示的变化。
⑴ 开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?
⑵
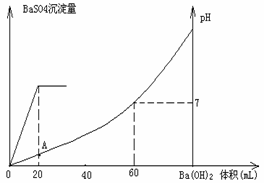 在A点溶液的pH是多少?
在A点溶液的pH是多少?
26.(6分)pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加_________mL;
(2)如果加入pH=10的NaOH溶液,应加_________mL;
(3)如果加0.01mol/L HCl,应加_________mL
25.(9分)以下是25℃时几种难溶电解质的溶解度:
|
难溶电解质 |
Mg(OH)2 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
溶解度/g |
9×10-4 |
1.7×10-6 |
1.5×10-4 |
3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子.如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,
过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,
充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,
将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为__________(填化学式)而除去.
(2)①中加入的试剂应该选择_____为宜,其原因是________________________.
(3)②中除去Fe3+所发生的总反应的离子方程式为___________________.
(4)下列与方案③相关的叙述中,正确的是______(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜或氧化铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
24.(8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
 ④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)该小组在步骤①中的错误是 ,
由此造成的测定结果 (偏高、偏低或无影响)。
(3)右图,是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.50 |
25.40 |
|
第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为 。
23.(8分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2) 若加入B(体积不变),则A的转化率_________,B的转化率_________。
 (填“增大”“减小”或“不变”,下同)
(填“增大”“减小”或“不变”,下同)
(3) 若升高温度,则平衡时B、C的浓度之比 将_________。
(4) 若加入催化剂,平衡时气体混合物的总物质的量_________。
(5) 若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______, 而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
22.(12分)常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3、 ②NaHCO3、 ③HCl、 ④NH3·H2O。
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为 _______________________________。
(3)向④中加入少量氯化铵固体,此时c(NH)/c(OH-)的值__________(填“增
大”、“减小”或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的 体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是
。
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com