
题目列表(包括答案和解析)
4.为减少大气污染,许多城市推广清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是( )。
A.氢气 B.一氧化碳 C.酒精 D.碳氢化合物
答案:D
3.下列石油分馏产物中,沸点范围最高的是( )。
A.汽油 B.煤油 C.柴油 D.燃料油
答案:D
2.石油的主要成分是( )。
①烷烃 ②烯烃 ③炔烃 ④二烯烃 ⑤环烷烃 ⑥芳香烃
A.①②③ B.①②④ C.①③⑤ D.①⑤⑥
答案:D
1.下列物质,不属于混合物的是( )。
A.汽油 B.石蜡 C氯仿 D.裂解气
答案:C
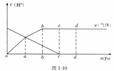 5.铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物为NH
5.铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物为NH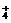 。请分析图1-10,回答有关问题:
。请分析图1-10,回答有关问题:
(1)假设任一气体产生的曲线段内只有一种还原产物,试配平b点到c点时反应的化学方程式:
□Fe+□HNO3□--□Fe(NO3)3+□□+□H2O
(2)从o点到a点时产生的还原产物为____________。
(3)a点到b点时产生的还原产物为__________________,其原因是__________________。
(4)已知到达d点时,反应完全结束,此时溶液中的主要阳离子为____________。且分析投入金属铁的物质的量之比nc(Fe):nd (Fe)=____________。
答案:(1)8Fe+30HNO3=8Fe(NO3)3+3NH4:NO3+9H2O
(2)NO
(3)N2O;Fe与HNO3反应时放热,当反应温度升高后,生成物为N2O
(4)Fe2+和NH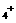 ;2:3
;2:3
4.实验室用NH3还原CuO)的方法测定Cu的近似相对原子质量,反应方程式为:2NH3+3CuO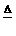 N2+3Cu+3H2O,试回答:
N2+3Cu+3H2O,试回答:
(1)如果实验选用测量反应物CuO和生成物H2O的质量[m(CmO)和m(H2O)]的方法时,请用图1-9所示的仪器设计一个简单的实验方案。
①仪器连接的顺序(用字母表示,仪器可重复使用)为______;d中浓H2SO4的作用是____________;实验完毕时观察到a中的现象为__________________。
②计算Cu的相对原子质量的表达式为____________。
③下列情况使测定结果偏大的是____________。
A.CuO未全部还原成Cu B.CuO受潮 C.CuO中混有Cu
 答案:①b、c、a、c、d;吸收未反应的NH3,防止空气中的水进入C;固体由黑变红
答案:①b、c、a、c、d;吸收未反应的NH3,防止空气中的水进入C;固体由黑变红
②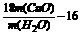
③AC
(2)如仍采用图1-9的装置,其他实验方案可选用测定的物理量有______。
A.m(Cu)和m(CuO) B.m(N2)和m(H2O) C.m(Cu)和M(H2O)
答案:BC
3.亚硝酸钠(NaNO2)可用作水泥施工的抗冻剂,它易溶于水,有咸味,既有氧化性,又有还原性。在酸性溶液中,它能氧化I-、Fe2+。它和酸反应生成亚硝酸(HNO2),亚硝酸是不稳定的弱酸,它只存在于冷的稀溶液中,易发生如下分解反应:3HNO2 =2NO↑+HN03+H2O。NaNO2能将人体内血红蛋白所含有的Fe2+氧化为Fe3+使人中毒。
在建筑工地曾多次发生把NmO2误作食盐食用,导致民工中毒事件。请从浓醋酸、氨水、纯碱、稀盐酸、碘化钾溶液、淀粉液中选择适当的物质,设计两个简单实验鉴别NaNO2和NaCl的方案。
方案(1):所加试剂______(限用一种试剂)。
现象是恼____________________________________。
方案(2):所加试剂______。
现象是____________________________________。
答案:(1)浓醋酸;试管口有红棕色气体生成
(2)稀盐酸、KI淀粉液;反应溶液呈蓝色
2.下图中①-11.分别代表有关反应中的一种物质,请填写以下空白:
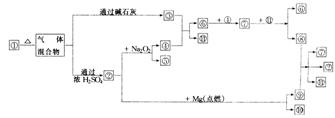
(1)①、③、④的化学式分别是______、______、______;
(2)⑧与⑨反应的化学方程式是______。
答案:(1)NH4HCO3;NH3;O2
(2)C+4HNO3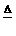 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
1.酸性氧化物和碱性氧化物相互作用可生成含氧酸盐,而硫代酸盐也可由酸性的非金属硫化物与碱性的金属硫化物反应制得。如:3Na2 S+As2S3=2Na3AsS3(硫代亚砷酸盐)。另外Na2S2类似Sa2O2的性质,完成下列反应方程式:
(1)Na2S和CS2反应:__________________;
(2)CaS和As2S3反应:__________________;
(3)Na2S2和盐酸反应:__________________。
答案:(1)Na2S+CS2=Na2CS3
(2)3CaS+As2S3=Ca3(AsS3)2
(3)Na2S2+2HCl=2NaCl+H2S↑+S↓
15.近年来,工业上用Mg(N03)2替代H2=SO4作为制取浓HNO3的脱水剂(以下数据均为溶质的质量分数)。65%的HNO3(质量为m1 )中加入72%的Mg(NO3)2溶液(质量为m2),分别得到97.5%的HNO3和60%的Mg(NO3)2溶液(不含HNO3)。
(1)若蒸馏过程中HNO3、Ng(NO3)2、H2O均无损耗,求蒸馏前的投料比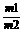 的值。
的值。
(2)蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(m1+m2)×5.0%的H2O流失。则投料时,比值 应该______(填“增大”、“减小”或“不变”)。
答案:(1)
(2)增大
拓展练习
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com