
题目列表(包括答案和解析)
5.下列各组试剂,只用试管和胶头滴管,不用任何其他试剂就可以鉴别的是( )。
A.KOH和A12(SO4 )3 B.稀HCl和Na2CO
C.CaCl2和Na2CO3 D.Ba(OH)2和NaHSO4
答案:AB
4.某原电池的总反应方程式为2Fe3++Fe=3Fe2+不能实现该反应的原电池为( )。
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为Fe,负极为锌,电解质溶液为Fe2(SO4)3
C.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
答案:BD
3.下列关于铜锌电池(电解质溶液为CuSO4溶液)的叙述正确的是( )。
A.铜锌原电池中铜是正极 B.铜锌原电池中,在锌极上析出铜
C.铜锌原电池中,在铜极上析出铜 D.铜锌原电池中,在锌极上析出H2
答案:AC
2.铝制品容器能盛浓硝酸而不被溶解的原因是( )。
A.铝金属活动性弱 B.浓硝酸的氧化性不强
C.浓硝酸使铝表面形成致密氧化膜 D.铝不与浓硝酸反应
答案:C
1.下列关于纯铁的描述正确的是( )。
A.熔点比生铁低
B.与相同浓度的盐酸反应生成H2的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀
D.在冷的浓硫酸中可钝化
答案:D
2.下表数据是在某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
|
反应时间t/h |
1 |
4 |
9 |
16 |
25 |
|
MgO层厚y/nm |
0.05a |
0.2a |
0.45a |
0.8a |
1.25a |
|
NiO层厚y′/nm |
B |
2b |
3b |
4b |
5b |
注:a和b均为与温度有关的常数。
请填空回答:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是 ____________________________________________。
(2)金属氧化膜的膜厚y跟时间t所呈现的关系是(填“直线”、“抛物线”、“对数”或“双曲线”等类型);MgO氧化膜膜厚y属_________型,NiO氧化膜膜厚y属________________型。
(3)Mg与Ni比较,哪一种金属具有更好的耐氧化腐蚀性?____________,其理由是_____________________ _______________________________。
答案: (1)化学反应速率是用单位时间内反应物的减少或生成物的增加来表示,因此金属腐蚀速率既可以用金属的消耗速率也可以用其氧化膜的生长速率来表示
(2)提示:不同的金属因其所形成的氧化膜致密程度不同,它们的耐腐蚀性也不同,即金的腐蚀速率不同,分析题中所列数据,运用数学知识找出其数字间的关系;MgO层厚y与时间t的关系为:y=0.05at,属于直线型图像;NiO层厚y'与时间t的关系为:y'=6t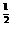 ,属于抛物线型图像
,属于抛物线型图像
(3)由数学知识可知:y'随时间t增长要比y随时间增长幅度小,因此镍的耐高温腐蚀性要比镁好
1.在2L容器中,加入0.4molA和0.6molB,在一定温度下,压强为P,加入催化剂(体积忽略)发生如下反应:
2A(g)+3B(g)⇌xC(g)+2D(g)
在amin后,容器中[A]=0.1mol/L
(1)若此时温度和压强均未改变,则υB和x的值是多少?
(2)若温度不变,压强变为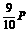 ,则υC和x的值是多少?
,则υC和x的值是多少?
答案: (1)因温度、压强均未改变,所以反应前后体积不变。
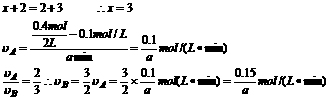
(2)x=2
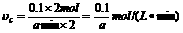
10.可逆反应aA(气)十bB(气)⇌cC(气)+dD(气)。取amolA和bmolB置于VL容器内,lmin后测得容器内A的浓度为xmol/L。这时B的浓度为_______________,C的浓度为______________,这段时间内反应的平均速率若以物质A的浓度变化来表示应为:_______________________________________。
答案: 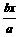 mol/L;(
mol/L;(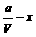 )·
)·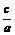 mol/L;(
mol/L;(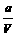 -x)mol/(L·min)
-x)mol/(L·min)
拓展练习
9.氯酸钾和亚硫酸氢钾间氧化还原反应的反应速率υ和时间t的关系如图2-1所示。又知这个反应的反应速率随溶液中氢离子浓度的增加而加快。
(1)反应开始阶段反应速率逐渐加快的原因是______________________________。
(2)反应后期反应速率逐渐下降的原因是______________________________。
答案: (1)由于生成H2SO4,c(H+)增大,则反应速率加快 (提示:开始阶段,发生如下反应:2KClO3+6KHSO3=3K2SO4+2KCl+3H2SO4)
(2)随时间的延长,KClO3不断消耗,并有H+和HSO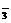 反应生成H2SO3,则反应速率减慢
反应生成H2SO3,则反应速率减慢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com