
题目列表(包括答案和解析)
6.下列关于杂化轨道的叙述中,不正确的是
A.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子
C.[Cu(H2O)6]2+和CH4两个分子中中心原子Cu和C都是通过sp3杂化轨道成键
D.杂化轨道理论常用于分析分子的空间构型
5、下列四种分子中中心原子杂化类型与三个不同的是
A、CH4 B、NH3 C、H2O D、BF3
4、若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
3、某元素原子价电子构型3d54S2,其应在
A、第四周期ⅦA族 B、第四周期ⅡB族 C、第四周期ⅡA族 D、第四周期Ⅶ族
2、下列电子排布式中属于基态原子的是
A、1S22S12P1 B、1S22S22P63S23P63d1
C、1S22S22P63S23P63d54S1 D、1S22S22P63S23P63d64S1
1、下列说法中正确的是
A、处于最低能量的原子叫基态原子 B、3p2表示3p能级有两个轨道
C、同一原子中,1s、2p、4p电子的能量逐渐减小
D、同一原子中,2p、3p、4p能级的轨道数依次增多
31.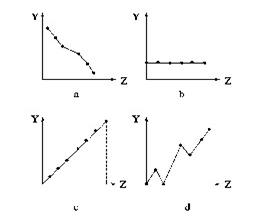 (1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的价电子数___________。(填曲线标号)
②第三周期元素的最高化合价__________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4; N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。
据此回答:①N的最高价氧化物对应的水化物的化学式为________ 。
②化合物A、B均为由上述四种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比B溶液中水的电离程度小。则B的化学式为_______ _。
30.1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键----三个O原子均等地享有这些电子。请回答:

 (1)臭氧与氧气的关系是
(1)臭氧与氧气的关系是
 (2)写出下列分子与O3分子的结构 最 相似的是
(2)写出下列分子与O3分子的结构 最 相似的是
A.H2O B. CO2 C.SO2 D. BeCl2
 (3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分 有
对孤对电子。
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分 有
对孤对电子。
 (4)O3分子是不是极性分子
。(填是或不是)
(4)O3分子是不是极性分子
。(填是或不是)
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能, PbS + O3 → PbSO4 + O2
 则生成1mol O2的转移电子物质的量为
mol。
则生成1mol O2的转移电子物质的量为
mol。
29.下表为元素周期表的一部分,请回答有关问题:
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑩的元素符号是__________;
(2)表中最活泼的金属是____,非金属性最强的元素是____;(填写元素符号)
(3)③和④比较,电负性较大的是______;第一电离能较大的是______(填元素符号)。
28.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为29。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)B的氢化物的分子空间构型是 。其中心原子采取 杂化。 (2)一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。 (3)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
(4)已知元素周期表可按电子排布分为五个区,则E元素在_______区。
(5) E的 价 电子排布式是_______ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com