
题目列表(包括答案和解析)
23.(10分)(1) (2) (3)
(4)
22.(12分) ⑴
⑵
⑶ 其理由是
⑷ 实验事实
21.(13分) (1) (2)
(3)
(4)
(5)
25.(12分)测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验流程如下:
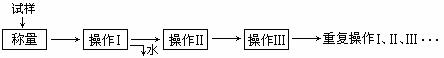
回答下列问题:
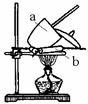 ⑴“操作I”是灼烧硫酸铜晶体,装置如右图。
⑴“操作I”是灼烧硫酸铜晶体,装置如右图。
指出装置中仪器名称:a_______________,b______________;
“操作I”之前应将块状的硫酸铜晶体放在______ _中研碎。
⑵“操作Ⅱ”的操作是________ _,必须在_____________ _中进行;
⑶ 判断硫酸铜晶体受热完全失去结晶水的依据是____ __(选填序号);
a.加热时无水蒸气 b.胆矾晶体由蓝变白
c.固体质量不再减小 d.固体质量不断减小
⑷ “重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作,判断达到恒重的依据是
___________________________________________________________ ____;
⑸做此实验时,最少应称量__________ __次。
⑹某学生实验后得到以下表数据:
|
加热前质量 |
加热后质量 |
|
|
m1(容器) |
m2(容器+晶体) |
m3(容器+无水硫酸铜) |
|
5.400 g |
7.900 g |
7.100 g |
①根据以上数据计算该硫酸铜晶体中结晶水x的值为_________________(精确到0.1)。
②该学生测定结果____________________(填“偏高”、“偏低”或“正确”)。
③从下列分析中选出该学生产生实验误差的原因可能是(填写字母)________________。
a.没有进行恒重操作 b.加热后在干燥器中冷却至室温后称量
c.加热过程中晶体有少量溅失 d.加热固体到白色后,露置在空气中冷却
古田一中2010-2011学年第二学期半期考试
高二化学《物质结构与性质》模块考试答案卷
24.(13分)常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaC1、MgC12等。请回答
(1)“氯盐类”融雪剂主要成分的晶体类型为 。
(2)冰比硫化氢溶点高的原因是 ,
其分子中氧原子的杂化轨道类型为 。
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
|
电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
|
X |
578 |
1817 |
2745 |
11578 |
|
Y |
738 |
1451 |
7733 |
10540 |
|
Z |
496 |
4562 |
6912 |
9543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的原因是 。
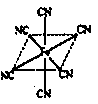 (4)融雪时刻对环境危害很大,如和路基上的铁等金属形成原电池,会加快路面面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如右图。
(4)融雪时刻对环境危害很大,如和路基上的铁等金属形成原电池,会加快路面面破损。铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如右图。
①铁元素基态原子价电子排布式为 。
②已知CN-与N2结构相似,1mol CN-中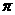 键数目为
。
键数目为
。
③上述沉淀溶解过程的化学方程式为 。
23.(10分)最近,由镁、镍和碳三种元素组成的化合物引起了科学家的注意。
(1)写出镍原子基态的价电子排布式 。
(2)比较第一电离能:Mg Al;C O(填>或<或=)。
(3)四羰基镍[Ni(CO)4]为无色挥发性剧毒液体。熔点-25℃。沸点43℃。不溶于水,易溶于乙醇、乙醚、苯、四氯化碳等有机溶剂,呈四面体构型。四羰基镍的晶体类型是
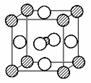
(4)据报道,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方最密堆积(如图),试写出该晶体的化学式 。晶体中每个镁原子周围距离最近的镍原子有 个。
|
22.(12分)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化。 单质在空气中燃烧,发出明亮的蓝紫色火焰。 |
单质常温、常压下是气体,能溶于水。 原子的M层有1个未成对的p电子。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
原子最外层电子层上s电子数等于p电子数。单质为空间网状晶体,具有很高的熔、沸点。 |
⑴B元素在周期表中的位置 ,写出A原子的价电子轨道表示式 。
⑵写出C单质与水反应的化学方程式 。
⑶D元素最高价氧化物晶体的硬度 (填“大 ”或“小”),其理由是 。
⑷A、B两元素非金属性较强的是(写元素符号) 。写出证明这一结论的一个实验事实 。
21.(13分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的结构式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
20.下列各项的叙述中都包含两个数值,前一数值大于后一数值的是 ( )
A.H2S中的分子间作用力和H2O中的分子间作用力
B.NaCl晶体中与一个Cl- 紧邻的Na+ 数和CsCl晶体中与一个Cl- 紧邻的Cs+ 数
C.晶体硅中Si-Si键的键能和金刚石中C-C键的键能
D.氨分子中N-H键的极性和甲烷分子中C-H键的极性
第Ⅱ卷(共60分)
19.实验室保存下列试剂,有错误的是( )
A.浓盐酸易挥发,盛在无色密封的玻璃瓶中
B.碘易升华,保存在盛有水的棕色试剂瓶中
C.液溴易挥发,盛放在用水密封的用玻璃塞塞紧的棕色试剂瓶中
D.溴化银保存在棕色瓶中
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com